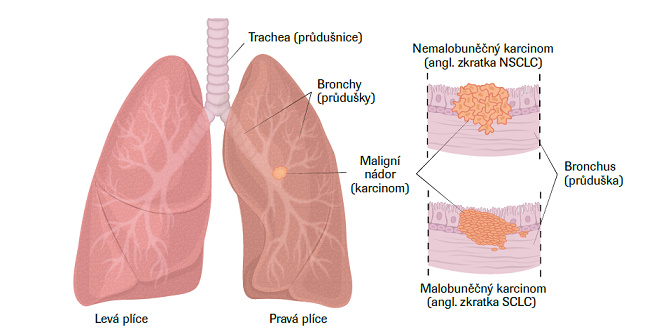
Plicní karcinom je značně heterogenní onemocnění. Plicní karcinomy velmi zjednodušeně dělíme podle biologického chování, histologického typu a subtypu. Pro praxi má stále ještě význam dělení na skupinu malobuněčných karcinomů (20–25 %) a skupinu nemalobuněčných karcinomů (přibližně 75–80 %), neboť z jejich rozdílných biologických vlastností vyplývá i rozdílný přístup k léčbě.
Morfologická diagnostika je stěžejním bodem v diagnostice plicního karcinomu, protože od morfologie se odvíjí další vyšetření i způsob léčby nádoru. Klasifikace plicních karcinomů (zejména nemalobuněčných) prodělala v posledních letech významné změny v důsledku rozšíření morfologické diagnostiky spolu s rozvojem imunohistochemie a nových poznatků v oblasti molekulární patogeneze nádorů. S tím souvisí i rozsáhlý vývoj nových léčiv, která zasahují do signálních drah karcinogeneze (cílená léčba) či přímo ovlivňují protinádorovou imunitu pacienta (imunoterapie). Tyto nové léky dávají nemocným větší šanci na delší přežití a lepší kvalitu života.
Stále náročnější diagnostika a léčba plicního karcinomu vyžadují správné rozhodnutí o nejoptimálnějším způsobu terapie. Návrh léčby by měl být výsledkem diskuse členů multidisciplinárního týmu (MDT). V těchto týmech bývá zastoupen hrudní chirurg, radiolog, pneumolog, klinický onkolog, radioterapeut, patolog a případně i psycholog, sociální pracovník atd. Při léčbě se uplatňuje princip personalizované terapie (léčby šité na míru pacienta, anglicky tailored therapy), která zohledňuje konkrétní specifika nádorového onemocnění i nemocného. Nádory stejného histologického typu se na molekulární úrovni často liší, což ovlivňuje zejména u pokročilých stadií onemocnění volbu terapie. Vyšetřování různých molekulárních biomarkerů se tak stalo nedílnou součástí diagnostického postupu plicního karcinomu, protože má prognostickou či prediktivní hodnotu. Léčba šitá na míru pacienta zlepšuje léčebné výsledky a zvyšuje bezpečnost léčby.
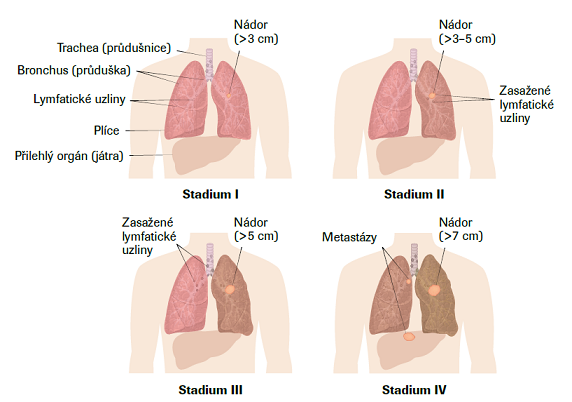
Pro diagnostiku plicního karcinomu je potřeba zkušený pneumolog, broncholog, radiolog, patolog a hrudní chirurg. Zásadní pro volbu terapie je správné stanovení rozsahu onemocnění, tj. určení stadia onemocnění I–IV (tzv. staging podle klasifikace TNM*, Classification of Malignant Tumours). V praxi se v současné době používá 8. vydání z roku 2017 (česká verze – 2018). Plicní karcinom bývá bohužel často diagnostikován až v pokročilém stadiu. Pouze zhruba 20 % nemocných má onemocnění diagnostikováno ve stadiu, kdy může být indikován radikální chirurgický výkon a pacient má šanci na trvalé či dlouhodobé vyléčení. Právě posouzení operability je zásadním úkolem onkologických týmů.
Nejlepší prognózu mají pacienti, u nichž byl nádor diagnostikován v operabilním stadiu (stadium I–IIIA) a byla provedena radikální resekce plicního laloku. Před operací je nutné přesně posoudit stadium nádoru (tzn. vyloučit vzdálené metastázy a posoudit rozsah postižení hilových a mediastinálních uzlin). Pokud je tumor dle provedených vyšetření operabilní, musí se určit maximální možný rozsah resekce plicní tkáně (atypická resekce, lobektomie, pneumonektomie) a posoudit operabilita pacienta (komorbidity, výsledky spirometrického či spiroergometrického vyšetření atd.). Výsledkem MDT by měl být závěr, zda je nádor potencionálně radikálně resekabilní a pacient je schopen operaci podstoupit s přiměřenými riziky.
Bronchoskopie je dominující metodou k získání vzorku tkáně nádoru. Bronchoskopicky je ověřeno zhruba 65 % plicních karcinomů. Komplexní bronchologie představuje nejen flexibilní bronchoskopii, ale i intervenční bronchologii s použitím rigidní bronchoskopie zvláště pro vyšetření lymfatických uzlin. Asi třetina nádorů není dosažitelná běžnou bronchoskopií, zde se pak mohou uplatnit různé navigační systémy jako skiaskopie, radiální ultrazvuk (EBUS) či CT navigace. Cílem diagnostické bronchoskopie je získat materiál na cytologické (cytoblok), histologické a molekulárně genetické vyšetření nádoru. Komplexní bronchologická diagnostika je zajišťována jen ve specializovaných centrech, kam by měl být pacient odeslán. Pokud není bronchoskopie výtěžná (často periferní léze), je možné indikovat transparietální punkci, exstirpaci metastázy či chirurgický výkon k mikromorfologickému ověření nádoru. Součástí histologického vyšetření je i molekulárně genetické vyšetření nádoru. Panel vyšetřených biomarkerů se liší podle typu nádoru.
U plicních nemalobuněčných karcinomů se dle histologického subtypu standardně vyšetřují mutace genu EGFR, ALK, ROS 1 a exprese PD-L1. V onkologických centrech toto probíhá automaticky. Pro indikaci cílené léčby a imunoterapie je znalost těchto prediktivních markerů nutná už od první linie léčby. Testování prediktivních faktorů se v ČR provádí v síti referenčních laboratoří. Vyšetření mutací EGFR a ALK u pokročilých nemalobuněčných plicních adenokarcinomů, adenoskvamózních karcinomů a nádorů bez bližší specifikace (NOS) se provádí reflexně v době stanovení diagnózy, mutace ROS 1 se vyšetřuje na vyžádání lékaře. Mutace EGFR, ALK, ROS 1 jsou prokázány u zhruba 15 % nemalobuněčných plicních karcinomů a pro indikaci cílené terapie (tyrozinkinázové inhibitory) je průkaz přítomnosti mutace nutný, neboť mutace genů EGFR, ALK, ROS 1 jsou pozitivním prediktorem účinnosti cílené léčby už od první linie léčby. Vyšetření exprese PD-L1 z histologického vzorku či cytobloku se nyní provádí u všech nemalobuněčných plicních karcinomů. Pacienti s expresí PD-L1 ≥1 % mohou dostávat imunoterapii od první linie léčby. Cílená léčba a imunoterapie jsou v současnosti používány především pro pokročilá stadia plicního karcinomu (III.–IV. stadium). Morfologická diagnostika plicního karcinomu je v současné době složitá a vyžaduje zkušeného patologa. V centrech bývá diagnostika většinou rychlejší. Výsledek histologického a molekulárně genetického vyšetření bývá zhruba do 7–10 dnů, někdy i dříve.
Nezbytnou součástí týmu je nejen klinický onkolog, ale také onkolog radioterapeut, protože u nádorů, které nebyly shledány operabilními, či pacient není schopen resekci podstoupit, je zvažována možnost radioterapie, ať už konkomitantní s chemoterapií, či sekvenční po proběhlé chemoterapii, nebo paliativní. Stejně tak je úkolem týmu vyhodnotit, zda pro pacienta není výhodné před operací podstoupit neoadjuvantní chemoterapii či radioterapii s cílem zmenšit nádor a zlepšit výsledek následné operace či dosáhnout operability, většinou u stadií III. Radioterapie je též potencionálně kurativní léčbou I. a II. stadia nemalobuněčného karcinomu plic u neoperabilních pacientů, pro které by byl chirurgický výkon neúměrným rizikem. Radioterapeut na týmu rovněž navrhne typ radioterapie (fotonová, či protonová, nebo případně stereotaktická radioterapie).
Závěr
Multidisciplinární tým složený z lékařů a specialistů různých odborností, kteří se podílejí na diagnostice a léčbě plicního karcinomu, je základem pro správnou diagnostiku a léčbu podle principu personalizované terapie. Multidisciplinární tým se schází pravidelně a vyjma pacientů diagnostikovaných a léčených přímo v onkologickém centru umožňuje konzultace lékařům i z jiných nemocnic, které jsou na centra napojeny. Nejmodernější a nejúčinnější léčba tak může být dostupná pro všechny nemocné bez ohledu na bydliště.
* Klasifikace TNM – slouží k popisu anatomického rozsahu solidních nádorových onemocnění v místě primárního nádoru/tumoru (T), v oblasti spádových mízních uzlin (N) a v místech vzdáleného orgánového metastatického postižení (M).