Screening nejčastějších aberací autozomů na podkladě volných fetálních fragmentů DNA v mateřské plazmě reprezentuje v současné době nejefektivnější vyhledávací test trizomie 21. Stále je nutné mít na paměti, že se jedná o test vyhledávací, ne diagnostický. V případě pozitivního nálezu je nutné nález potvrdit invazivní diagnostickou metodou. Testování mikrodelečních syndromů pomocí NIPT má horší pozitivní prediktivní hodnotu vzhledem k nízké prevalenci onemocnění v populaci. Je vhodné dbát a myslet na mateřské faktory, které mohou mít vliv na výsledek testu. Mezi tyto faktory patří obezita matky, aktivní autoimunitní onemocnění, neoplastický proces a mozaicismus. Rychlý rozvoj technologií v této oblasti zcela jistě ovlivní směr a vývoj prenatální diagnostiky.
Úvod
Fragmenty volné DNA a RNA jsou přítomny ve všech tělních tekutinách v určitém dynamickém stavu, který podléhá neustálé obměně. Jedná se o malé extracelulární fragmenty DNA cirkulující v krevním oběhu, pro které se v anglosaské odborné literatuře vžilo označení cell-free DNA (cfDNA). Technologický progres molekulárně genetických postupů posledních dvaceti let učinil tento jedinečný genetický materiál dostupným pro zcela novou generaci krevních testů vhodných detekovat a monitorovat onemocnění.
V roce 1997 byly publikovány první práce o fetálním a placentárním původu cfDNA v mateřské cirkulaci. 1 V rámci péče o těhotnou ženu byla problematika fetální cfDNA a technologie DNA sekvenace velice rychle implementována do širší klinické praxe formou vyhledávacích testů prenatálního screeningu nejčastějších chromozomálních aberací. Jedná se o průlomovou technologii, která představuje revoluci v rámci screeningu vývojových vad.
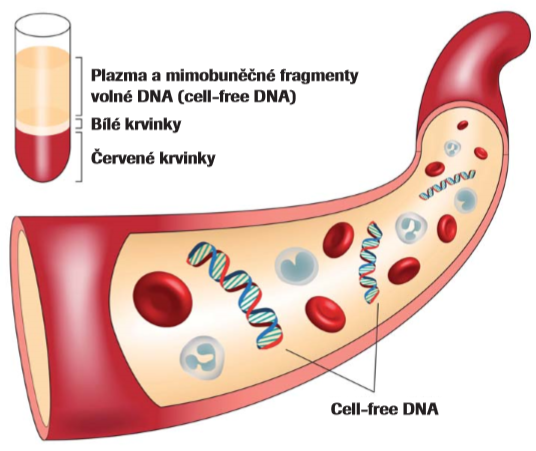
Biologie cfDNA
Naprostá většina plazmatické cfDNA je uvolněna z hematopoetických buněk v rámci normálního buněčného cyklu. Zároveň se na celkovém poolu cfDNA spolupodílí i řada jiných orgánů, příkladem jsou adipocyty tukové tkáně. 2 Za normálních okolností, není-li žena těhotná, reflektuje genomický profil plazmatické cfDNA individuální karyotyp jedince. Během těhotenství se placentární cfDNA rovněž uvolňuje do mateřské plazmy a tuto lze využít pro účely prenatální diagnostiky. Tento typ DNA fragmentů pochází ze zevního cytotrofoblastu, do mateřské cirkulace se dostává prostřednictvím apoptózy. 3 První průkaz fetoplacentární DNA v cirkulaci matky byl detekován pomocí specifických sekvencí Y chromozomu. CfDNA mající fetoplacentární původ je označována jako cff DNA (cell-free fetal DNA) a je detekována v cirkulaci matky od pátého gestačního týdne. Představuje přibližně 10–15 % celkového objemu cfDNA. 4 Koncentrace cff DNA se zvyšují s gestačním týdnem a po ukončení těhotenství se koncentrace rychle snižuje až k absolutní eliminaci. Cff DNA reprezentuje zdroj informací o probíhající graviditě a neperzistuje do dalšího těhotenství. 5
Terminologie
V souvislosti s volnou DNA v cirkulaci jsou často ne zcela správně používány některé termíny a označení. Pro klinickou praxi je však nutné znát jejich správný význam. Prenatální test založený na analýze cff DNA mateřské plazmy je označován v anglosaské odborné literatuře pomocí zkratky NIPT (noninvasive prenatal testing). Rovněž se lze v této souvislosti setkat možná s výhodnějším termínem, kterým je neinvazivní prenatální screening (NIPS – noninvasive prenatal screening). Toto označení přesněji vystihuje povahu testu a diferencuje jej od tradičních diagnostických a invazivních diagnostických intervencí hodnotících fetální karyotyp na základě analýzy buněk získaných biopsií choriových klků a odběru plodové vody. Test fetálních aneuploidií pomocí cff DNA z mateřské plazmy nedosahuje přesnosti diagnostického vyšetření pro aneuploidii a v případě pozitivity vyžaduje provedení diagnostického vyšetření karyotypizací. Existují však i testy využívající cff DNA z mateřské plazmy, splňující požadavky diagnostického testu bez nutnosti verifikace invazivní intervencí. Jedná se o NIPD (noninvasive prenatal diagnosis), tyto jsou však primárně určeny pro detekci paternálních dědičných stavů plodu (unikátní fetální DNA sekvence, které nejsou obsaženy v mateřském genotypu). 6
Tradiční screeningové metody fetálních aneuploidií
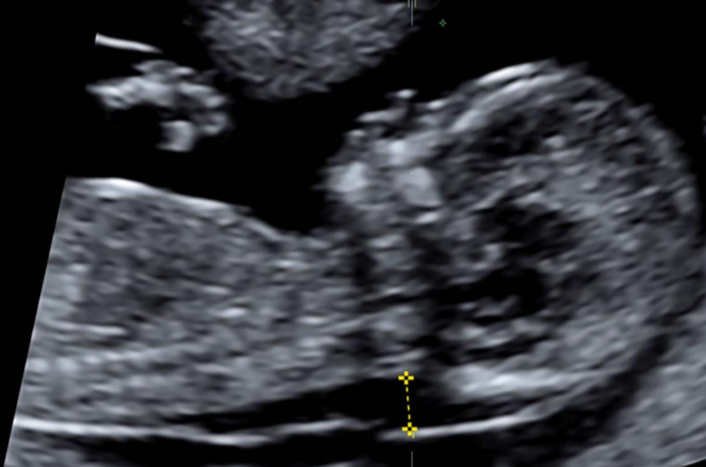
U fyziologicky se vyvíjejícího plodu lze koncem prvního trimestru gestace prokázat kumulaci tekutiny v podkoží oblasti fetálního krku a záhlaví. Sonografický nález nahromaděné tekutiny je v anglosaské odborné literatuře označován termínem nuchal translucency. 7 V české odborné literatuře se pro nález kolekce tekutiny v oblasti záhlaví plodu pozorovaného koncem prvního trimestru vžil termín šíjové projasnění. U zdravých plodů se šíře šíjového projasnění zvětšuje s hodnotou CRL. Maximální hodnota se pozoruje kolem 13. týdne a následně se šíře snižuje. Po 14. gestačním týdnu je parametr neměřitelný. 8,9 Šíjové projasnění reprezentuje nejvýznamnější sonografický minor marker I. trimestru těhotenství, který nevykazuje významnou vazbu na biochemické markery mateřského séra I. trimestru free β-hCG a PAPP-A. Závislost mezi parametrem projasnění šíje a biochemickými markery nebyla prokázána u plodů s trizomií 21 ani u plodů s normálním karyotypem. Vzhledem k neexistující závislosti sonografického markeru na biochemických markerech lze obě skupiny kombinovat a využít k individuální kalkulaci rizika chromozomální aberace (trizomie 21) v rámci screeningu. Kombinací hodnoty šíjového projasnění, hodnot biochemických markerů a věku těhotné lze detekovat 90 % plodů s trizomií 21 při 5% falešné pozitivitě. 10 Využitím algoritmu pro detekci trizomie 21 lze potvrdit 75 % procent plodů s trizomií 18 a 13. Kombinací s určením srdeční frekvence a zařazením specifického algoritmu pro trizomii 18 a 13 lze docílit 91% detekce trizomie 18 a 87% detekce trizomie 13. 11 Společně se šíjovým projasněním lze individuální riziko pro chromozomální aberaci dále upřesnit s využitím dalších sonografických markerů I. trimestru gestace. Jedná se o nosní kost, obličejový úhel a dva dopplerovské parametry zahrnující vyšetření fetálního venózního duktu a hodnocení toku na trikuspidální chlopni. Zatímco nosní kost a obličejový úhel mají vztah k chromozomálním aberacím, u dopplerovských parametrů lze v případě venózního duktu navíc prokázat vztah k přítomnosti závažné srdeční vady a riziku fetálního úmrtí. Odchylky toku na trikuspidální chlopni vykazují asociaci s aberacemi chromozomů a se srdečními vadami.
Využití NIPT pro detekci trizomie 21, 18 a 13
Základní princip NIPT u trizomie 21 je založen na detekci zvýšeného počtu DNA fragmentů 21 chromozomu v mateřské plazmě. Plod s trizomií 21 uvolňuje do mateřské cirkulace – v důsledku přítomnosti třetí kopie 21 chromozomu – více DNA fragmentů 21 chromozomu v porovnání s ostatními chromozomy. DNA sekvenace cfDNA mateřské plazmy, obsahující směs mateřské a fetální DNA, umožňuje podrobný odhad dávky fetálního chromozomu 21 (dvě nebo tři kopie) prostřednictvím určení počtu fragmentů vycházejících z každého chromozomu. Počet fragmentů 21 chromozomu je následně porovnán a vztažen k referenčnímu počtu ostatních předpokládaných diploidních chromozomů. Následná statistická analýza určí, zda je přítomen vyšší počet chromozomu 21. K dispozici je několik NIPT platforem využitelných k detekci aneuploidií:
a) Masivní paralelní sekvenace: v anglosaské odborné literatuře je tento přístup označován jako MPS (massively parallel sequencing) nebo také náhodná celogenomová sekvenace (random whole genome sequencing). Metoda umožní rychlou sekvenaci malých oddílů „reads“, náhodně vybraných DNA fragmentů na úrovni jednotlivých nukleotidů. Pouze část každého DNA fragmentu je sekvenována. Většinou se jedná o fragment o 36 párech bází. I tato malá část však postačí, aby byl fragment DNA mapován a umístěn na odpovídající chromozom původu. 12 I když uvedená metoda pracuje se směsí DNA fragmentů a nerozlišuje mezi fragmenty mateřskými a fetálními, byly v roce 2008 publikovány práce demonstrující identifikaci fetální trizomie. 13,14
MPS metoda počítá směrodatnou odchylku odhadovaného počtu každého chromozomu a stanoví z-skóre. Pokud je počet fragmentů 21 chromozomu v testovaném vzorku zvýšený o více než 3 směrodatné odchylky oproti normě, je riziko trizomie 21 chromozomu zvýšené.
b) Chromozom selektivní cílená sekvenace: v anglosaské odborné literatuře je tento přístup označován jako CSS (chromosome-selective sequencing). Na rozdíl od předešlé metody, kdy dochází k sekvenaci směsi DNA fragmentů plazmy, je u CSS plazma obohacena o preselektované fragmenty chromozomů 13, 18, 21 a pohlavních chromozomů. Proces obohacení je realizován prostřednictvím metody PCR (polymerase chain reaction), kdy dochází k amplifikaci segmentů DNA, které jsou jedinečné pro daný chromozom. Finální DNA směs, která je podrobena sekvenaci, je bohatá na fragmenty uvedených chromozomů a náklady a čas sekvenace jsou tímto redukovány. Individuální odhad rizika trizomií nebo aberací gonozomů je následně počítán s využitím parametrů populačního rizika (mateřský věk a gestační stáří), výsledku sekvenace a fetální frakce. Riziko 1 : 100 a více reprezentuje vysoce rizikovou skupinu.
c) SNP sekvenace: v anglosaské odborné literatuře je tento přístup označován jako single nucleotide polymorphism based sequencing (sekvenace na podkladě jednonukleotidového polymorfismu). U této metody je DNA extrahována z mateřské plazmy (obsahuje mateřskou cfDNA a cff DNA) a z mateřských leukocytů (pouze mateřská celulární DNA). Následně dochází k cílené amplifikaci ~ 20 000 SNPs chromozomů 21, 18, 13, X a Y. Poté je měřena variabilita na každém SNP lokusu. Fetální genotyp je odvozen na základě porovnání výsledku sekvenace mateřských leukocytů a plazmy. SNP sekvenace je schopna rozlišit mezi mateřským a fetálním zdrojem DNA a může rovněž obsahovat paternální zdroj genetické informace. 15
Fetální frakce
Důležitým faktorem ovlivňujícím provedení NIPT je údaj o fetální frakci. Fetální frakce udává podíl cff DNA v celkové cf DNA mateřské plazmy. 16 Pokud je podíl fetální frakce nízký, je detekce aneuploidie plodu obtížnější. Je celá řada biologických faktorů, které mají na podíl frakce vliv. Například zvýšená hmotnost těhotné ženy významně negativně souvisí s fetální frakcí. Až 7 % těhotných žen s hmotností nad 100 kg má fetální frakci < 4 %. Řada laboratoří udává podíl fetální frakce kolem 4 % jako hraniční pro analýzu. Vedle hmotnosti matky ovlivňuje hodnotu frakce gestační stáří a typ chromozomální aberace.
Senzitivita a specificita NIPT
Efektivita NIPT v rámci screeningu fetálních aneuploidií je vysoká a dosahuje lepších výsledků než standardní rutinně používané vyhledávací testy. Metaanalýza prací publikovaná v roce 2016 prokázala senzitivitu NIPT pro detekci trizomie 21; 99,3 %, trizomie 18; 97,4 % a trizomie 13; 97,4 %. 17 V témže roce vydává Americká společnost lékařské genetiky a genomiky stanovisko, že lze na základě recentních dat informovat těhotné ženy o možnosti využití NIPT jako nejefektivnějším screeningovém testu pro trizomii 21, 18 a 13. 18 Pro klinickou praxi je rovněž důležitý údaj o specifitě screeningového testu. Test s vysokou specificitou znamená málo falešně pozitivních výsledků, tento parametr vyhledávacího testu je žádoucí, jelikož klesá skupina žen indikovaných k invazivní intervenci pro pozitivitu (falešnou) testu. Specificita pro trizomii 21 je vysoká, 99,9 %. Celková kumulativní falešná pozitivita testu pro aneuploidie 21, 18, 13 a aberace gonozomů je 0,72 %. Tedy přibližně 1 : 140. Tato relativně suboptimální hodnota jde na vrub X chromozomu a je způsobená nepoznaným mateřským mozaicismem a věkem podmíněnými ztrátami. 19 Pozitivní prediktivní hodnota (PPH) je parametr charakterizující vyhledávací test. Udává pravděpodobnost onemocnění v případě, že je výsledek screeningového testu pozitivní. To znamená v případě NIPT, že výsledek vyšel v pásmu zvýšeného rizika. Senzitivita a specificita jsou charakteristiky testu vlastní, negativní a pozitivní prediktivní hodnota záleží na charakteru složení populace a frekvenci výskytu nemoci, kde je test prováděn. PPH bude nižší v nízkorizikové populaci žen a naopak. PPH je nižší pro chromozomy 13, 18 a pohlavní chromozomy v porovnání s chromozomem 21.
Iniciální studie a využití NIPT byly původně prováděny na vysoce rizikových populacích. Zde dosahovala PPH pro trizomii 21 80–90 %. Recentní data demonstrují, že PPH NIPT předčí výsledky kombinovaného screeningu I. trimestru v neselektované populaci. V kohortě těhotných s průměrným věkem 30 let (riziko trizomie 1 : 700) je PPH NIPT pro trizomii 21 45,5 a pro trizomii 18 40 %. Z uvedeného je zřejmé, že pozitivní výsledek NIPT je nutno potvrdit diagnostickou metodou, zvláště pak, je-li ve hře varianta ukončení těhotenství. V případě, že pár obdrží informaci, že je výsledek NIPT testu negativní a riziko aneuploidie je nízké, je pravděpodobnost přítomnosti fetální aneuploidie velice nízká. I když je tato informace velice uklidňující, test 100% nevyloučil přítomnost fetální aneuploidie. Pravděpodobnost falešně negativního testu pro trizomii 21 v rizikové populaci (1 : 100) je udávána v poměru 1 : 10 000. Abychom znali skutečnou falešnou negativitu testu, potřebujeme mít k dispozici rozsáhlé studie na neselektované populaci s větším počtem falešně negativních nálezů.

Selhání metody
Neschopnost předat páru výsledek NIPT testu je spojen s nízkou fetální frakcí, selháním laboratorní metody nebo administrativní chybou. V anglosaské odborné literatuře jsou tyto stavy označeny termínem „no call results“. Jednou z nejčastějších příčin nedostupnosti výsledků NIPT testu je nízká fetální frakce vyšetřovaného vzorku. Podmínkou pro získání výsledku je minimální přítomnost fetální frakce 2–4 %. 20 Fetální frakce je ovlivněna řadou biologických faktorů, jako je například váha matky, četnost těhotenství, gestační stáří. Typ NIPT testu má rovněž vliv na frekvenci jeho selhání. Nejvyšší pravděpodobnost selhání je uváděna u sekvenace na podkladě jednonukleotidového polymorfismu (6,4 %). Naopak nejnižší pravděpodobnost selhání je udávána u masivní paralelní sekvenace (1,6 %). 21 Určité typy fetálních aneuploidií, mezi které patří například trizomie 13 a triploidie, bývají rovněž často spojeny se sníženou fetální frakcí a selháním metody. Proto je nutné počítat s možností přítomnosti fetální aneuploidie v případě, kdy není dostupný výsledek z důvodu nízké fetální frakce, a přizpůsobit tomu genetickou konzultaci. Zvýšená mateřská hmotnost rovněž snižuje fetální frakci a je nutno tímto směrem obézní těhotné informovat.
V roce 2016 publikovaná metaanalýza udává selhání testu mezi 0–12,7 %. V souboru 5 789 žen, které měly iniciální selhání testu a u nichž proběhl druhý odběr, jich 13,9 % mělo opět selhání metody.
Management v případě selhání metody by měl být veden v souladu s možnými příčinami, které k selhání mohou vést. Na prvním místě je třeba uvažovat o možnosti selhání v důsledku možné přítomné fetální aneuploidie. Možnosti, které máme k dispozici, jsou následující: a) kombinovaný screening I. trimestru, pokud se těhotná nachází ve vhodném období I. trimestru; b) podrobné sonografické vyšetření se zaměřením na ultrazvukové markery chromozomální aberace; c) diagnostickou invazivní intervenci. Opakovat NIPT může být úspěšné až v 50 % případů, nicméně může nastat časová prodleva v případě opakovaného selhání metody. Těhotná se může dostat do vyšších gestačních týdnů, což v případě průkazu přítomnosti fetální aneuploidie a případného ukončení gravidity ve vyšším gestačním týdnu není žádoucí. Americká společnost lékařské genetiky a genomiky nedoporučuje NIPT v případě selhání opakovat. 13
Klinická implementace
Existuje několik návrhů klinické implementace NIPT. V současné době se diskutuje kontingenční model provedení NIPT. Pacientkám, které podstoupily kombinovaný test v I. trimestru s výsledkem vysokého individuálního rizika, je nabídnuta invazivní diagnostická intervence. Ženám s intermediálním individuálním rizikem je nabídnut NIPT. Ve Velké Británii proběhly studie sledující efektivitu kontingenčního provedení NIPT u pacientek s kombinovaným testem I. trimestru nebo II. trimestru, u nichž bylo individuální riziko vyšší než 1 : 1000. Výsledky demonstrovaly zvýšenou detekci plodů s trizomií 21, nižší incidenci invazivních diagnostických intervencí a pokles těhotenských ztrát v důsledku komplikace v návaznosti na amniocentézu či biopsii choria, bez rozdílu finančních nákladů mezi skupinami. 23,24 Na základě uvedených studií subjekt ve Velké Británii mající na starosti screeningové programy doporučil NIPT u všech těhotných s individuálním rizikem vyšším než 1 : 150. Obdobný trend lze zaznamenat i v ostatních zemích Evropy (Nizozemsko) a Ameriky (Kanada). Americká společnost lékařské genetiky a genomiky navrhuje doporučení NIPT ženám s rizikem fetální aneuploidie. 13
Další z možností, jak aplikovat NIPT, je jeho univerzální využití v kombinaci se sonografickým vyšetřením konce I. trimestru. Tato varianta je spojena s nejvyšší detekcí, ale i nejvyššími ekonomickými náklady. 25
Případy nevhodné k NIPT
NIPT představuje výborný screeningový test pro nejčastější aberace autozomů a gonozomů, ale není schopen podat tak detailní popis stavu jako invazivní diagnostika. Před NIPT by mělo být provedeno sonografické vyšetření mezi 11–14. gestačním týdnem. Až v 16 % případů rizikových pacientek lze detekovat nález popisující odlišnou dataci, vícečetnou graviditu, zamlklé těhotenství nebo přítomnost strukturální vady. 26 Pokud je NIPT proveden u pacientky se zvýšeným rizikem méně běžné chromozomální aberace (jiná než trizomie 21, 18, 13 a X nebo Y), je nutné pacientku informovat o potenciální možnosti nedetekovat klinicky významnou chromozomální aberaci, kterou bychom bez obtíží detekovali pomocí klasické invazivní diagnostiky. Dalšími skupinami, kdy není NIPT vhodný, je sonografický nález strukturální vady, hodnoty abnormálního šíjového projasnění > 3,5 mm nebo extrémně abnormální nález sérových analytů mateřského séra v I. trimestru (byl-li proveden). 27 Není vhodné indikovat NIPT u pacientek s vysokým individuálním rizikem na základě výsledku kombinovaného testu I. trimestru. V případě vysokého rizika je indikovaná invazivní diagnostika. Trizomie 21, 13 a 18 představují zhruba 71 % všech chromozomálních aberací. 28 Pokud bychom u pacientek s rizikem vyšším než 1 : 50 nebo závažným morfologickým ultrazvukovým nálezem volili NIPT, nepodaří se detekovat 1 případ závažné aneuploidie z 302. Pokud konzultujeme pár, který vyžaduje maximum informací týkajících se těhotenství, je vhodnější indikovat rovnou diagnostický test stanovující karyotyp.
NIPT a aberace gonozomů
Prevalence monozomie X (Turnerův syndrom) je udávána mezi 1–1,5 %. 30 Je doprovázena vysokým rizikem těhotenské ztráty. NIPT u monozomie X byl zaveden v roce 2012 a řada výrobců v současné době test nabízí. Řada aberací gonozomů však zcela nesplňuje klasická kritéria pro celoplošný screening. Z tohoto důvodu se kolem NIPT u aberací gonozomů objevují četné, hlavně etické diskuse. Dalším potenciálním zdrojem diskusí je přesnost NIPT u aberací gonozomů, která není tak vysoká jako u trizomie 21, 18 a 13. Příčinou je vyšší potenciál pro maternální biologickou variabilitu X chromozomu. Míra detekce (detection rate) Turnerova syndromu pomocí NIPT se pohybuje kolem 90,3 % při falešné pozitivitě 0,23 %.
Subchromozomální abnormality
Jsou zodpovědné za celou řadu dobře definovaných genetických syndromů, jako je například 22q11.2 deleční syndrom (Di George sy.), Cri du chat, Prader-Willi sy., Angelman sy. a jiné. Jejich příčina tkví v duplikaci nebo deleci DNA v rámci chromozomu. Řada těchto subchromozomálních abnormalit je příliš malá, aby byla detekována v rámci klasického vyšetření karyotypu, a tak jsou detekovány molekulárně cytogenetickými metodami (microarray). U 1,7 % sonograficky nepodezřelých plodů s normálním výsledkem klasického cytogenetického vyšetření je pomocí microarray detekována klinicky významná abnormalita na subchromozomální úrovni. 31 Od roku 2013 řada výrobců nabízí NIPT platformu pro screening subchromozomálních abnormalit. Vzhledem k jejich nízké prevalenci (klinicky významné) je pozitivní prediktivní hodnota NIPT screeningu podstatně nižší než u ostatních aberací. Vysoká negativní prediktivní hodnota reflektuje spíše vzácnost jejich výskytu než efektivitu testu samotného. 32
Neshoda výsledku screeningového a diagnostického testu
Karyotyp materiálu získaného amniocentézou odráží skutečný karyotyp plodu, jelikož je stanoven ze skutečně fetálních buněk. V případě NIPT však mohou nastat stavy falešné pozitivity, jelikož je analyzován materiál DNA mateřského a fetoplacentárního původu. Můžeme tak detekovat odchylku, která má mateřský či placentární původ, nevyskytuje se však u plodu. Příčinami této biologické falešné pozitivity jsou například syndrom mizejícího dvojčete, placentární mozaicismus, mateřská mikrodelece nebo neoplazie matky. 33
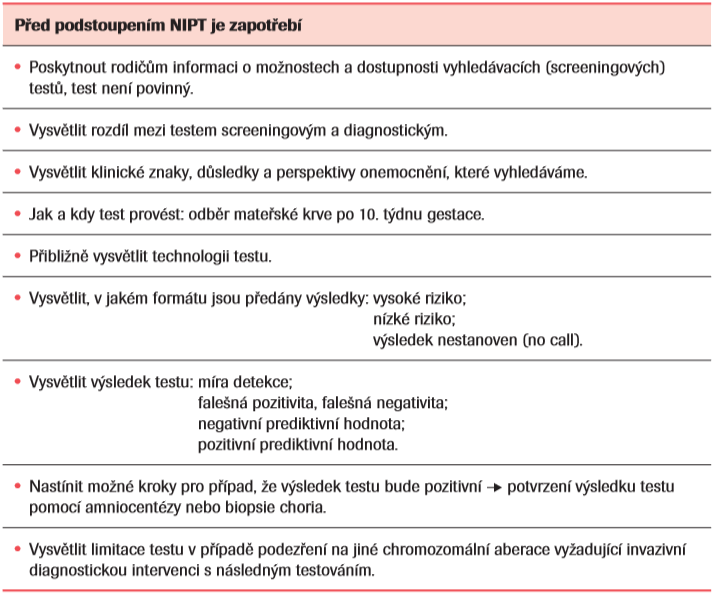
Zavedení NIPT zásadně změnilo koncepci screeningu vrozených vývojových vad. Jeho dostupnost klade větší nároky na konzultující lékaře a vyžaduje dokonalé pochopení principu, výhod a limitací tohoto testu, včetně jeho umístění do stávajících a etablovaných vyhledávacích testů. Body vhodné k diskusi s rodiči před podstoupením NIPT jsou uvedeny v tabulce 1.
Závěr

Screening nejčastějších typů autozomálních aneuploidií (trizomie 21, 18 a 13) na podkladě cff DNA v mateřské cirkulaci patří v současné době k nejlepšímu vyhledávacímu testu s mimořádnou senzitivitou a specifitou. Implementace tohoto testu do klinické praxe představuje pro zdravotníky výzvu. Důvodů je několik, technologie je zcela nová a rychle se dále vyvíjí, stále se učíme správně porozumět biologii cfDNA v mateřské plazmě a nelze opomenout ani ekonomické hledisko. Co se týče trizomie 21, 18 a 13, jedná se o screeningový test pro nízko i vysoko rizikovou populaci těhotných, který však kvůli existenci vzácné falešné pozitivy nedosahuje přesnosti diagnostického testu. Přesah NIPT k ostatním chromozomálním odchylkám a mikrodelečním syndromům nás nutí revidovat naše dosavadní zažité pohledy na prenatální screening.