Cílem práce bylo zhodnotit význam a využití výsledků stanovení celkového tau proteinu (tTau), fosforylovaného tau proteinu (pTau) a amyloidu beta (1-42) (β-amyloidu) v likvoru u pacientů s Alzheimerovou nemocí a pacientů s jinou neurologickou diagnózou.
Úvod
Alzheimerova nemoc je nejběžnější formou progresivní demence u starší populace. Histologicky ji lze charakterizovat akumulací β-amyloidu v extracelulárních placích a ukládáním hyperfosforylovaného tau proteinu v intracelulárních neurofibrilárních klubkách.1,2 Změny na mozku se objevují řadu let před prvními příznaky choroby. Stanovení biochemických markerů ukazujících na průběh uvedených dějů může mít proto značný prognostický význam.3
Na výzkumu Alzheimerovy choroby (AD) se významně podílel britský chemik Christopher Martin Dobson (1949–2019), který objevil a popsal konformační přeměny proteinů (obr. 1). Ukázal, že vlivem nesprávné konformace vznikají nerozpustné proteinové agregáty, dochází k usazování amyloidových vláken a že k neurodegenerativním onemocněním dochází následkem kumulace těchto struktur. Je tak narušena fyziologická schopnost mozku odstraňovat metabolický odpad včetně β-amyloidu.
Tato vlastnost se postupně ztrácí s věkem, což zvyšuje pravděpodobnost vzniku Alzheimerovy choroby. Dobsonovy poznatky nastínily cestu k léčbě AD v budoucnu. 4,5,6
Dosavadní dostupná léčba pouze zpomaluje průběh onemocnění. Výzkum se zaměřuje na lék, který by měnil terciální strukturu proteinů tak, aby se zabránilo formování amyloidových fibril a tvorbě plaků.4,5,6
Biochemické markery Alzheimerovy choroby
tTau
Tau protein je bílkovina vázaná na mikrotubuly neuronů. Podílí se na stabilizaci sítě jejich cytoskeletu. Vyšší koncentrace tau proteinu se do likvoru uvolňují při degeneraci neuronů. Za patologických podmínek může docházet k tvorbě nerozpustných agregátů způsobujících synaptickou dysfunkci a smrt neurálních buněk.7 Patologické zvýšení tau proteinu v likvoru je popisováno především u Alzheimerovy choroby, ale v některých případech roste také při cévní mozkové příhodě, poranění mozku či u jiných neurodegenerativních onemocnění.8,9
pTau
Tau protein často podléhá posttranslačním úpravám, mezi něž patří acetylace, deamidace, glykace, methylace a patologicky velmi významná fosforylace. Ta nejčastěji probíhá na hydroxyskupinách aminokyselin serinu a threoninu. Enzymy, které označujeme jako kinázy, hydroxyskupiny substrátu fosforylují, enzymy, které označujeme jako fosfatázy, substrát defosforylují. Za normálních okolností existuje rovnováha mezi defosforylací a fosforylací. Problém nastává, když fosforylace proteinu převáží nad jeho defosforylací, tau protein začne poškozovat mikrotubuly a může docházet k jeho agregaci. V mozku pacientů s AD je tau protein hyperfosforylovaný.8,9
β-amyloid
Amyloid beta (1-42) vzniká z amyloidového prekurzorového proteinu. Tvoří hlavní komponentu amyloidových plaků. V likvoru u Alzheimerovy choroby je hydrofobní β-amyloid snížený vzhledem ke své agregaci a ukládání. Představuje nejčasnější změny během rozvoje AD.10
Homocystein
Jedním z rizikových faktorů pro neurologická onemocnění je zvýšená koncentrace homocysteinu v plazmě. Koncentrace homocysteinu v mozku vzrůstá s věkem. Vyšší koncentrace S-adenosyl homocysteinu v likvoru souvisí se zvýšenou koncentrací a nižší degradací pTau. Lze se tedy domnívat, že snížení hladin homocysteinu může chránit mozek proti kumulaci fosforylovaného tau proteinu.11
Leptin
K nezávislým rizikovým faktorům AD patří obezita a životní styl. V tomto smyslu může hrát významnou roli stanovení leptinu – anorexigenního hormonu syntetizovaného v adipocytech. Leptin vykazuje neuroprotektivní vlastnosti, inhibuje amyloidogenní procesy, redukuje koncentraci fosforylovaného tau proteinu, a tak zlepšuje kognitivní funkce.1
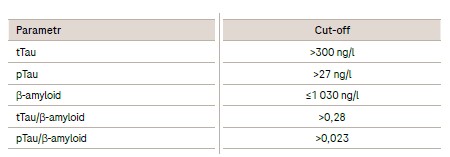
Při hodnocení výsledků tTau, pTau a β-amyloidu byly využity cut-off hodnoty Roche uvedené v tabulce 1. V patologických případech dochází ke zvýšení tTau, pTau, poměrů tau proteinů/β-amyloidu a snížení β-amyloidu.
Materiál a metody
Stanovení tTau, pTau i β-amyloidu 1-42 bylo provedeno na přístroji cobas® 8000, modul e 801, s využitím elektrochemiluminiscenčního nekompetitivního stanovení pomocí reagencií Roche 2. generace (kat. č. 08821941 190 – β-amyloid, 08846685 190 – tTau, 08846715 190 – pTau). Biomarkery byly měřeny v likvoru získaném lumbální punkcí. Pracovali jsme se souborem 47 pacientů z Neurologické a Psychiatrické kliniky Brno. Projekt by schválen Etickou komisí FN Brno (č. j. 01-090119/EK) jako Start-up grant. Všichni pacienti poskytli informovaný souhlas a byli rozděleni do dvou skupin. Skupina 1 zahrnovala 24 probandů s demencí neurodegenerativního rázu (AD, frontotemporální demence, smíšená demence, CMP + sekundární kognitivní deficit, ethylismus). Průměrný věk pacientů v této skupině byl 70 (55–85) roků. Do skupiny 2 bylo zařazeno 23 probandů s jinou neurologickou diagnózou (neuroborelióza, cefalea, myelomalácie, serózní meningitida). Věkový průměr v této skupině byl 56 (29–81) roků. Ke statistickému vyhodnocení byl použit nepárový Mann-Whitney test (pro tTau, pTau, tTau/β-amyloid a pTau/β-amyloid) a dvouvýběrový t-test (pro β-amyloid) v programu MedCalc, verze 12.5.0.
Výsledky
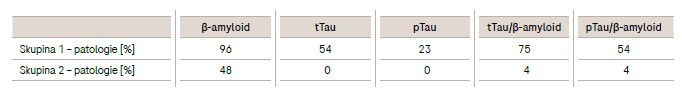
Procentuální zastoupení patologických výsledků v souboru pacientů s demencí neurodegenerativního rázu a v souboru pacientů s jinou neurologickou diagnózou u parametrů β-amyloid, tTau, pTau, tTau/β-amyloid a pTau/β-amyloid je uvedeno v tabulce 2. Nejvíce patologií jsme zaznamenali u β-amyloidu – 96 % ve skupině 1 a 48 % ve skupině 2. Parametr tTau se zvýšil u 54 % pacientů ve skupině 1 a zůstal pod hodnotou cut-off u všech pacientů ze skupiny 2 (viz tabulka 2).
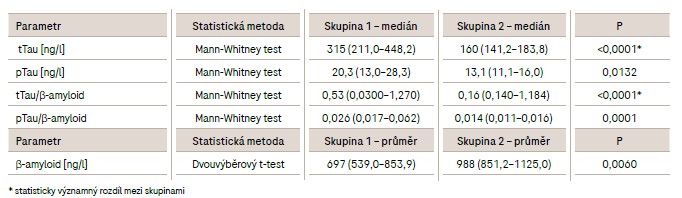
Při statistickém porovnání parametrů β-amyloid, tTau, pTau, tTau/β-amyloid a pTau/β-amyloid u souboru pacientů s demencí neurodegenerativního rázu a souboru pacientů s jinou neurologickou diagnózou byl pozorován statisticky významný rozdíl u tTau a tTau/β-amyloid (P <0,0001), viz tab. 3.
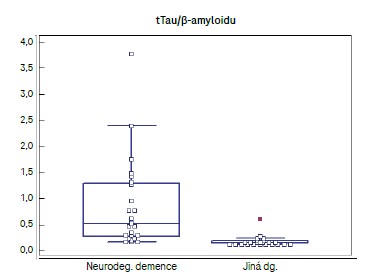
U ostatních sledovaných parametrů byly rozdíly mezi skupinami statisticky nevýznamné. V grafické podobě prezentujeme pouze srovnání skupin u poměru tTau/β-amyloid (obr. 2).
Diskuse
Ve shodě s literárními údaji2,8 naše výsledky ukazují, že v likvoru u pacientů s Alzheimerovou chorobou dochází k nárůstu tau proteinu celkového i fosforylovaného a ke snížení amyloidu beta (1-42). U Alzheimerovy choroby je významné diagnostikovat onemocnění co nejdříve, protože léky zpočátku mohou pozastavit progresi onemocnění a ovlivnit vývoj a kvalitu života nemocného i jeho rodiny.12 K tomu přispívá stanovení tTau, pTau a β-amyloidu. Znalost koncentrace a vývoje těchto parametrů a jejich poměrů v likvoru má význam prognostický, k upřesnění stupně a vývoje Alzheimerovy choroby a v neposlední řadě v diferenciální diagnostice u neurodegenerativních onemocnění. Ukazuje se, že s využitím zmíněných laboratorních údajů není obtížné odlišit pacienty s AD jak od zdravých jedinců, tak i od pacientů s jiným typem demence včetně vaskulární, normotenzního hydrocefalu a také sekundární demence způsobené vlivy, jako je například alkoholismus.2 V souboru sledovaném v této studii jsme pracovali s pacienty s různými diagnózami a bylo v něm pouze 5 pacientů s diagnostikovanou Alzheimerovou nemocí. Rozborem výsledků se ukazuje, že u pacientů s AD dochází mnohem častěji k patologii všech sledovaných parametrů současně (u 4 jedinců z 5). U pacientů s jinou neurodegenerativní demencí tomu tak není. Tito pacienti mají mimo normu pouze 2–3 z pěti sledovaných parametrů. K patologiím zde dochází nejčastěji u β-amyloidu (96 % ve skupině s demencí neurodegenerativního rázu a 48 % ve skupině s jinou neurologickou diagnózou). To ho řadí k citlivým prognostickým parametrům, který klesá již před vypuknutím klinických příznaků demence, ale také snižuje jeho význam při odlišení jednotlivých diagnóz. Parametry tTau, pTau a používané poměry se jeví výrazně specifičtější (viz tabulky 2 a 3). Situaci komplikuje pozorování, že značné procento pacientů trpí demencí smíšenou.
Lehmann a kol. měřili tTau, pTau a β-amyloid v likvoru v multicentrické studii s 1 743 pacienty s různými neurologickými onemocněními a vysokou hodnotou tTau s cílem získat cut-off pro diferenciální diagnostiku AD versus ostatní onemocnění. Ve sledovaném souboru bylo 105 pacientů trpících Alzheimerovou nemocí. Dle autorů pro Alzheimerovu chorobu svědčí pTau >60 pg/ml, β-amyloid <550 pg/ml a β-amyloid/pTau >8,3.13 Tato kritéria umožňují jasnou diagnostiku. V našem souboru však nebyl jediný pacient s koncentrací pTau >60 pg/ml. Při hodnocení výsledků jsme proto vycházeli z cut-off hodnot v příbalových informacích firmy Roche3 – viz tabulka 1. Při určení diagnózy neurologové vycházeli především z výsledků zobrazovacích metod a z klinického stavu pacientů. V některých případech však došlo k upřesnění diagnózy právě s využitím výsledků tau proteinů a β-amyloidu. V práci budeme pokračovat, abychom při dalším hodnocení významu stanovení tTau, pTau a β-amyloidu měli k dispozici výsledky většího počtu pacientů. Za nevýhodu považujeme, že stanovení tTau, pTau a β-amyloidu použitou metodikou je nutno provádět pouze z likvoru a je k němu tedy třeba invazivní odběr pomocí lumbální punkce.
Závěrem můžeme konstatovat, že stanovení tau proteinu celkového i fosforylovaného a amyloidu beta (1-42) má význam při diferenciální diagnostice, zjišťování závažnosti postižení i sledování progrese Alzheimerovy choroby a dalších neurodegenerativních onemocnění.