Současný rozvoj sekvenování nové generace (Next Generation Sequencing; NGS) dramaticky mění lékařskou praxi. Spolu s klesajícími náklady se NGS stává standardem v rutinní diagnostice u pacientů s onemocněním s významnou genetickou složkou. Výjimkou není ani využití NGS pro identifikaci pacientů s dědičnými nádorovými syndromy.
Většina nádorů je považována za sporadická onemocnění způsobená kumulací mutací během života pacienta. Uvádí se, že dědičné nádorové syndromy představují pouze přibližně 5–15 % případů všech onkologických onemocnění. Přesto pacienti s dědičnou nádorovou predispozicí představují klinicky významnou část nemocných – riziko vzniku nádoru/nádorů je u nich vysoké, nádory se často objevují v nízkém věku a obvykle se jedná o onemocnění s autozomálně dominantním typem dědičnosti, a tedy s 50% rizikem přenosu patogenní mutace na potomky. Identifikace nádorové predispozice tak má zásadní význam v prevenci nádorového onemocnění v postižených rodinách. Mutace zodpovědné za dědičná nádorová onemocnění postihují v drtivé většině tumor-supresorové geny. Inaktivace druhé (nemutované) alely tumor-supresorových genů v nádorové tkáni způsobuje funkční selhání jejich proteinových produktů, která se často projevují poruchami v regulaci buněčného cyklu či apoptózy a defekty oprav poškození DNA1.
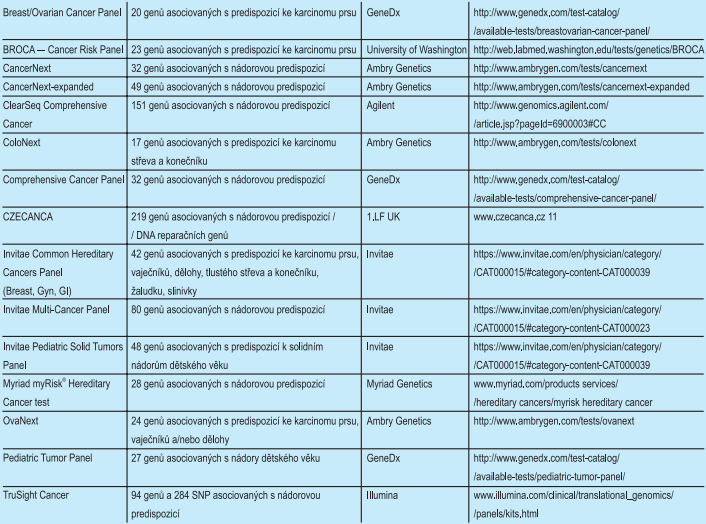
V současné době jsou nádorové predispoziční geny testovány v různém rozsahu především pomocí cíleného sekvenování. V praxi nejčastěji používanými jsou amplikonové sekvenování (cílové oblasti DNA jsou obohaceny pomocí multiplexní PCR) a panelové sekvenování (k obohacení dochází pomocí specifických hybridizačních sond)2. Panely používané pro analýzu nádorových predispozičních genů se v jednotlivých diagnostických laboratořích liší, používány jsou jednak komerčně dostupné panely3, je však možné si vytvořit vlastní panel plně splňující požadavky konkrétní diagnostické laboratoře (tab. 1).
Ze strany pacientů a klinických genetiků sílí poptávka po testování více genů, z čehož mohou profitovat především pacienti dosud negativně testovaní na přítomnost mutací v hlavních predispozičních genech. Tyto geny se vyznačují nejvyšší pravděpodobností záchytu příčinné mutace u daného nádorového syndromu4. Současným trendem je jednoznačně přechod od amplikonového sekvenování k sekvenování panelovému a tím i k analýze většího množství nádorových predispozičních genů najednou. Například u pacientky s karcinomem ovaria můžeme v rámci jedné analýzy vyšetřit geny spojené nejen se syndromem dědičného karcinomu prsu a ovaria (geny BRCA1 či BRCA2), jejichž mutace lze identifikovat až u 15 % nemocných, ale zároveň i další geny, jako jsou mutátorové geny, jejichž mutace způsobují Lynchův syndrom (s geny MSH1, MSH2, MSH6), který je kromě vysokého rizika vzniku karcinomu kolorekta spojen rovněž se zvýšeným rizikem karcinomu ovaria.
Panelové sekvenování rovněž umožňuje analýzu nádorové predispozice u pacientů s vysokou rodinnou zátěží či s vícečetným nádorovým onemocněním, kteří nesplňují rigorózní indikační kritéria genetického testování pro žádný známý nádorový syndrom, avšak predispozice k nádorovému onemocnění je u nich evidentní. Spolu s rozšířením NGS do klinické praxe přibývá případů naznačujících, že klinická manifestace nádorových syndromů, jak jsme ji znali doposud, se může lišit a jejich projevy se mohou překrývat. Tato fakta jsou jen dalším argumentem pro přechod od klasických metod (HRM, Sanger sekvenování a jiné) analýzy jednotlivých genů k NGS, zejména k panelovému sekvenování celých sad nádorových predispozičních genů.
Vysoký výkon NGS umožňující sekvenování mnoha genů přináší zcela nové otázky, ale rovněž prohlubuje problémy, kterým jsme čelili ještě před érou NGS. Hlavní výzvou NGS se nyní stává klinická interpretace výsledků sekvenování. Z hlediska klinického významu jsou identifikované alterace v nádorových predispozičních genech zařazeny do jedné z pěti IARC tříd na základě své patogenity5:
1 = benigní varianta,
2 = pravděpodobně benigní varianta,
3 = varianta nejasného významu,
4 = pravděpodobně patogenní varianta,
5 = patogenní varianta.
Varianty třídy 1 a 2 jsou považovány za klinicky nevýznamné a naopak varianty třídy 4 a 5 za mutace související se vznikem onemocnění. Analýza většího počtu genů vede k záchytu mnoha variant nejasného významu (variant of unknown signifikance; VUS). U těchto obvykle populačně vzácných variant se nejsme schopni bezprostředně vyjádřit k jejich vlivu na funkci proteinu, a tedy ani k jejich klinickému významu. K hodnocení VUS je nezbytné použít další genetické, biologické či in-silico přístupy. V případě genetického hodnocení VUS se provádí segregační analýza sledující vazbu varianty s onemocněním v postižené rodině. Tento přístup je v naší populaci často omezený z důvodu malé velikosti vyšetřovaných rodin. Vliv testované varianty na výši relativního rizika vzniku onemocnění lze na základě asociačních analýz vypočítat z četnosti VUS ve skupině pacientů a zdravých kontrol stejné populace. Biologické analýzy studují funkční význam varianty in vitro především na modelových systémech stabilních buněčných linií nebo in vivo za použití geneticky modifikovaných organismů. Tyto metody jsou však často technicky i časově velmi náročné.
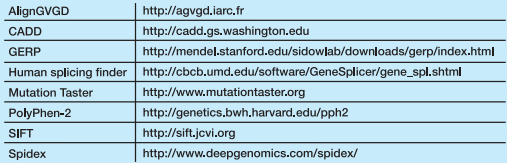
K usnadnění analýzy významu VUS byla proto vyvinuta řada pomocných in silico nástrojů (tab. 2) zahrnujících predikční algoritmy. Tyto softwarové programy využívají pro analýzu vlivu testované mutace na funkci proteinu míru evoluční konzervovanosti, rozdíly v biochemických vlastnostech mezi původní a nově zařazenou aminokyselinou či možný vliv mutace na sestřih. Přestože počítačová predikce umožňuje rychlé hodnocení pravděpodobného vlivu studované varianty na funkci proteinu, je její význam pouze pomocný, např. pro prioritizaci variant určených pro biologické a genetické analýzy. Protože v případě VUS se obvykle jedná o velmi vzácné varianty, jejich klasifikace probíhá cestou rozsáhlé mezinárodní spolupráce různých mezinárodních konsorcií (např. ENIGMA, CIMBA), která shromažďují fenotypové údaje o nosičích těchto variant.
Dalším úskalím interpretace dat z NGS je záchyt mutací v genech, které nejsou podle dosavadních znalostí v přímém příčinném vztahu s onemocněním pacienta (tzv. nevyžádané/náhodné nálezy patogenních variant; „incidental findings“), nebo záchyty prokazatelně patogenních variant popsaných však u zcela jiných nádorových syndromů (tzv. diskordantní výsledky). Interpretace přítomnosti těchto variant je velkou výzvou pro klinické genetiky, kteří by měli pacienta během genetické konzultace upozornit na možnost náhodného nálezu patogenní mutace a s tím spojené důsledky tak, aby se pacient mohl vyjádřit, zda chce být o náhodném záchytu mutace informován. Bohužel doporučení, jak pečovat o nosiče mutací, jsou v současné době dostupná pouze pro relativně malý počet genů a chybí zatím u řady genů, které jsou již dnes považovány za vysoce pravděpodobné nádorové predispoziční geny. Proto se názory na to, o kterých mutovaných nádorových predispozičních genech pacienta informovat (tedy které geny reportovat), liší (samozřejmě s ohledem na informovaný souhlas pacienta). Tuto nejednotnost reflektuje i přístup jednotlivých laboratoří, a to i v rámci České republiky, kde se setkáváme s různou praxí:
- Laboratoř reportuje pouze mutace/VUS v genech vyžádaných klinickým genetikem. Výsledky sekvenování nevyžádaných genů jsou skryty v průběhu bioinformatického zpracování dat. Interpretátor výsledků sekvenování tak nemusí čelit problému, zda nalezenou mutaci v nevyžádaném genu reportovat či nikoliv. Na druhou stranu pro klinického genetika může být někdy velmi obtížné dopředu rozhodnout, který gen by mohl být ve spojení s onemocněními v dané rodině a měl by tedy být vyšetřen.
- Laboratoř reportuje mutace/VUS vyžádaných klinickým genetikem, a navíc nálezy patogenních mutací pouze v genech s vysokou až střední penetrancí, jež mohou být ve vztahu k nádorovému onemocnění. Příkladem může být reportování nalezené patogenní mutace v genu MLH1 (Lynchův syndrom) u pacientky s karcinomem prsu a s výskytem karcinomu prsu a kolorekta v rodině. Pokud by vyšetření tohoto genu nebylo klinickým genetikem vyžádáno, tak by laboratoří z první skupiny nebylo reportováno.
- Laboratoř reportuje všechny nalezené mutace. Tento přístup je však extrémně náročný pro bioinformatické vyhodnocení pravděpodobného biologického významu všech nalezených variant v laboratoři a zejména pro klinického genetika (jak při prvotní konzultaci a odebírání informovaného souhlasu s vyšetřením, tak při hodnocení klinického významu reportovaných variant a seznámení pacienta s výsledkem vyšetření).
Posun v problematice reportování nevyžádaných záchytů mutací představují doporučení Americké společnosti lékařské genetiky a genomiky (American College of Medical Genetics and Genomics; ACMG), která v roce 2015 publikovala seznam 56 genů, ve kterých by náhodně zachycené mutace měly být v případě souhlasu pacienta reportovány. Jedná se o mutace v genech spojených s dědičnými nádorovými syndromy (APC, BRCA1, BRCA2, MEN1, MLH1, MSH2, MSH6, MUTYH, PMS2, RB1, RET, SDHAF2, SDHB, SDHC, SDHD, TP53, VHL, WT1, PTEN, STK11), ale i s dalšími onemocněními (ACTA2, ACTC1, APOB, CACNA1S, COL3A1, DSC2, DSG2, DSP, FBN1, GLA, KCNH2, KCNQ1, LDLR, LMNA, MYBPC3, MYH11, MYH7, MYL2, MYL3, MYLK, NF2, PCSK9, PKP2, PRKAG2, RYR1, RYR2, SCN5A, SMAD3, TGFBR2, TMEM43, TNNI3, TNNT2, TPM1, TSC1, TSC2, TGFBR1), u nichž znalost o nosičství mutace umožňuje včasnou lékařskou intervenci a představuje tedy významný benefit pro pacienta6,7.
S dalším rutinním použitím NGS bude rovněž nezbytné systémově rozhodnout, jakým způsobem přistoupit k problému náhodných záchytů mutací v genech, jež jsou spojeny s autozomálně recesivními syndromy. Mutace v těchto genech nejsou v heterozygotním stavu spojeny s vysokým rizikem vzniku nádorového onemocnění, avšak v homozygotním stavu (tedy v případě postižení obou alel a absence funkčního proteinu) jsou spojeny se závažným postižením v dětském věku. Příkladem mohou být mutace v genu NBN, jež jsou v heterozygotním stavu spojeny s 2–3x zvýšeným rizikem vzniku karcinomu prsu (jedná se tedy pravděpodobně o gen se středním rizikem vzniku nádorového onemocnění)8, v homozygotním stavu jsou zodpovědné za Nijmegen breakage syndrom (MIM#251260). Informování pacienta/rodiny o nosičství mutace by umožnilo testování partnerů nosičů, a pokud by byla nalezena u partnera patogenní mutace ve stejném genu, pár by se mohl rozhodnout pro preimplantační diagnostiku a předejít tak narození dítěte s velmi závažným postižením. V současné klinické praxi však pacienti často nejsou o této možnosti informováni ani v případě záchytu mutací v genech testovaných již od 90. let minulého století. Například mutace genu BRCA2, které jsou v heterozygotním stavu spojeny s vysokým rizikem vzniku dědičné formy karcinomu prsu, vaječníků a dalších solidních nádorů (MIM#612555)9, v homozygotním stavu jsou zodpovědné za vznik vzácného, avšak závažného onemocnění Fanconiho anémie komplementační skupiny D1 (MIM#605724)10.
V současné době se na řadě pracovišť v České republice diagnostika dědičných nádorových syndromů sjednocuje díky použití společného sekvenačního panelu CZECANCA (219 genů; Nimblegen, Roche)11, který je určen pro analýzu dědičné predispozice napříč nejčastějšími nádorovými syndromy. Zároveň probíhá projekt sekvenování kontrol (jedinci starší alespoň 60 let bez výskytu nádorového onemocnění v rodině) pomocí stejného panelu. Cílem je zjistit frekvenci mutací v analyzovaných genech v naší populaci, protože je známo, že mezi jednotlivými populacemi se frekvence mutací může značně lišit. Příkladem je mutace c.657_661del5 v genu NBN (tab. 3).
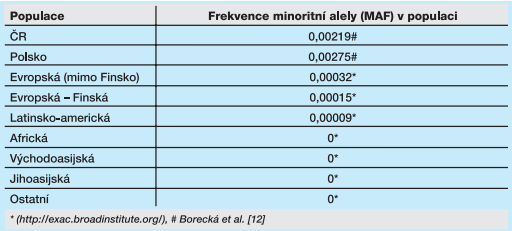
Znalost populačních rozdílů ve frekvenci mutací umožní přesnější odhad relativního rizika vzniku onemocnění u nosičů mutace. Dostatečný počet kontrolních genotypů tedy usnadní interpretaci populačně specifických variant s cílem maximalizovat výhody NGS v klinické praxi v ČR.
Doufejme, že toto úsilí povede k dalšímu rozšíření NGS do rutinní diagnostiky dědičných nádorových syndromů a tím ke zlepšení péče o onkologické pacienty a jejich rodiny.