Stanovení biomarkerů β-amyloidu 1-42 (Ab42), celkového tau proteinu (T-Tau) a fosforylovaného tau proteinu 181 ( P-Tau) je využíváno v rámci diferenciální diagnostiky neurodegenerativních onemocnění, zvláště Alzheimerovy choroby (Alzheimer's disease, AD). Cílem naší práce bylo porovnání neurodegenerativních markerů dvěma typy diagnostických souprav.
Úvod
Neurodegenerativní onemocnění, jako je Alzheimerova choroba (AD) a další související demence, postihují téměř 44 milionů lidí na celém světě.1 Nejčastěji se s nimi setkáváme u osob starších 65 let, jejich prevalence s věkem stoupá a podle odhadu se vzhledem k rostoucí délce života počet lidí s demencí v příštích 30 letech zdvojnásobí.2 Z tohoto důvodu jsou hledány laboratorní biomarkery, které by pomohly diagnostikovat tuto chorobu v časných stadiích. V současné době je při podezření na řadu onemocnění centrálního nervového systému (CNS) doporučováno základní vyšetření mozkomíšního moku (CSF), a to posouzení vzhledu likvoru, kvantitativní stanovení počtu buněčných elementů, celkové bílkoviny, glukózy a laktátu.3 Pro podrobnější diferenciaci nemocí CNS je poté doporučováno stanovení konkrétních biomarkerů. Z hlediska diferenciace neurodegenerativních onemocnění se jedná o stanovení likvorové koncentrace beta-amyloidu 42 (Ab42), celkového tau proteinu (T-Tau), popř. fosforylovaného tau proteinu 181 (P-Tau).
Tau protein jako nízkomolekulární neurocytoskeletální protein se může vyskytovat až v 6 různých izoformách, které se liší délkou polypeptidového řetězce.4 Účastní se výstavby mikrotubulů, která je řízena fosforylací a defosforylací. Defosforylovaný tau protein přispívá k polymerizaci a stabilizaci mikrotubulů, kdežto fosforylovaný tau protein se z jejich vazby uvolňuje a tím vede k jejich rozpadu. Za fyziologických okolností je mezi těmito dvěma pochody udržována rovnováha zajišťující potřebnou stabilitu mikrotubulů.5 Za patologických podmínek se fosforylované formy tau proteinu uvolňují za tvorby párových helikálních filament agregujících za vzniku neurofibrilárních klubíček.6 Přítomnost těchto obtížně odbouratelných intracelulárních depozit tau proteinu je typická pro neurodegenerativní onemocnění označované jako tauopatie, jejímž hlavním představitelem je AD. Následkem může být rozpad buňky se současným uvolněním tau proteinu do extracelulárního prostoru. Zvýšená koncentrace celkového tau proteinu společně s fosforylovaným tau proteinem v CSF tak patří k ukazatelům AD.
Beta-amyloid vzniká z amyloidového prekurzorového proteinu, který je fyziologickou součástí buněčné membrány. V klinické praxi se využívá převážně stanovení izoformy Ab42 končící alaninem na rozdíl od kratší izoformy Ab40 končící valinem, která za fyziologických okolností převažuje, je solubilní a tělem vylučována. Rychle agregující izoforma Ab42 je tak dominující formou beta-amyloidu uloženého v placích. Jeho snížená koncentrace u pacientů s AD je pak vysvětlována právě jeho zvýšenou adherencí v perineuronálních neuritických placích.7
Senzitivita a specificita Ab42 pro diagnostiku AD oproti kontrolní skupině je odhadována z řady studií na 86 % a 90 %; pro celkový T-Tau 81 %, resp. 90 %, a pro P-Tau 80 %, resp. 92 %. Při kombinovaném hodnocení senzitivity a specificity byly pro Ab42 a T-Tau získány hodnoty 85–94 %, resp. 83–100 % ve skupině s AD oproti kontrolní skupině.8 Nicméně při hodnocení specificity těchto biomarkerů pro AD vzhledem k ostatním demencím byly její hodnoty mnohem nižší.9 Současně byly pozorovány rozdíly v absolutních koncentracích těchto biomarkerů napříč různými laboratořemi. Tyto rozdíly mohou být způsobeny rozdílnými preanalytickými i analytickými podmínkami.10,11 Cílem naší práce bylo porovnání neurodegenerativních markerů dvěma typy diagnostických souprav, korelace mezi absolutními koncentracemi jednotlivých biomarkerů a jejich vzájemnými poměry a posouzení jejich vzájemné výpovědní hodnoty na základě shody klinické interpretace.
Metodika
Pacienti
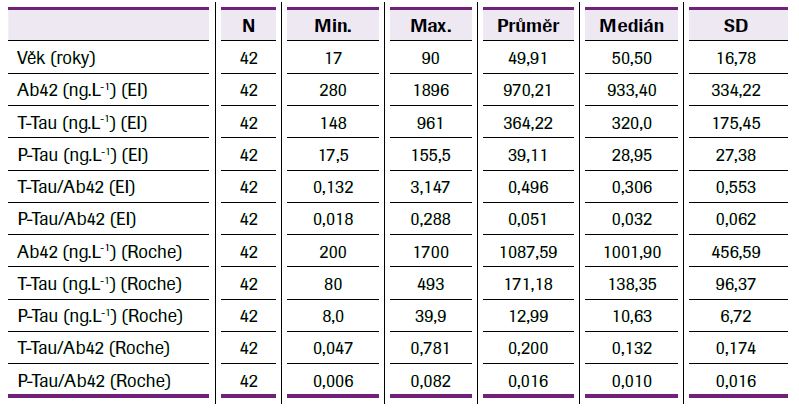
Do studie bylo zařazeno 42 vzorků pacientů z Neurologické kliniky Fakultní nemocnice Ostrava s podezřením na neurodegenerativní onemocnění. Průměrný věk celé skupiny byl 49,9 ± 16,8 let. Skupinu tvořilo 33 žen s průměrným věkem 51,1 ± 15,3 let a 9 mužů s průměrným věkem 45,6 ± 22,0 let. Soubor pacientů byl dále rozdělen do následujících diagnostických skupin: Alzheimerova choroba (AD) (n = 3), jiné demence (D) (n = 6), Parkinsonova choroba (PD) (n = 3) a kontrolní skupina (Co) (n = 30). Všichni pacienti podepsali informovaný souhlas s použitím zbytkového biologického materiálu pro výzkumné účely. Kromě pohlaví a věku byly všechny údaje o pacientech anonymní.
Vzorky
Vzorky likvoru studovaných jedinců byly odebrány standardizovaným způsobem do polypropylenových zkumavek (Sarstedt, Nümbrecht, Německo). Vzorky byly centrifugovány při 390 × g po dobu 10 minut za pokojové teploty a supernatanty byly poté uchovány v kryozkumavkách (0,5 ml na kryozkumavku) a skladovány při -70 °C do doby analýzy. Analytické metody Ke stanovení Ab42, T-Tau a P-Tau v likvoru byly použity dvě imunoanalytické metody s odlišným způsobem detekce, elektrochemiluminiscenční detekce využívající značení rutheniovým chelátem na plně automatickém analyzátoru cobas 6000 firmy Roche a imunoenzymatická detekce využívající bezbarvého chromogenního substrátu (ELISA) na analyzátoru DSX (Euroimmun; EI). V případě automatizovaného analyzátoru cobas 6000 byly použity diagnostické soupravy Elecsys Total-Tau CSF, kat. č. 07356994 190, Elecsys Phospho-Tau (181P) CSF, kat. č. 07357036 190, a Elecsys β-Amyloid (1-42) CSF, kat. č. 06986811 190. V případě ELISA stanovení byly použity diagnostické soupravy Total-Tau determination in CSF, kat. č. EQ 6531-9601-L, Beta-amyloid (1-42) determination in CSF, kat. č. EQ 6521-9601-L, a P-Tau (181) determination in CSF, kat. č. EQ 6591 9601 L (Euroimmun). Ke statistickému zpracování dat byly použity programy Excel a MedCalc verze 17.9.7. U všech použitých testů byla statistická významnost posuzována na hladině P = 0,05.
Výsledky
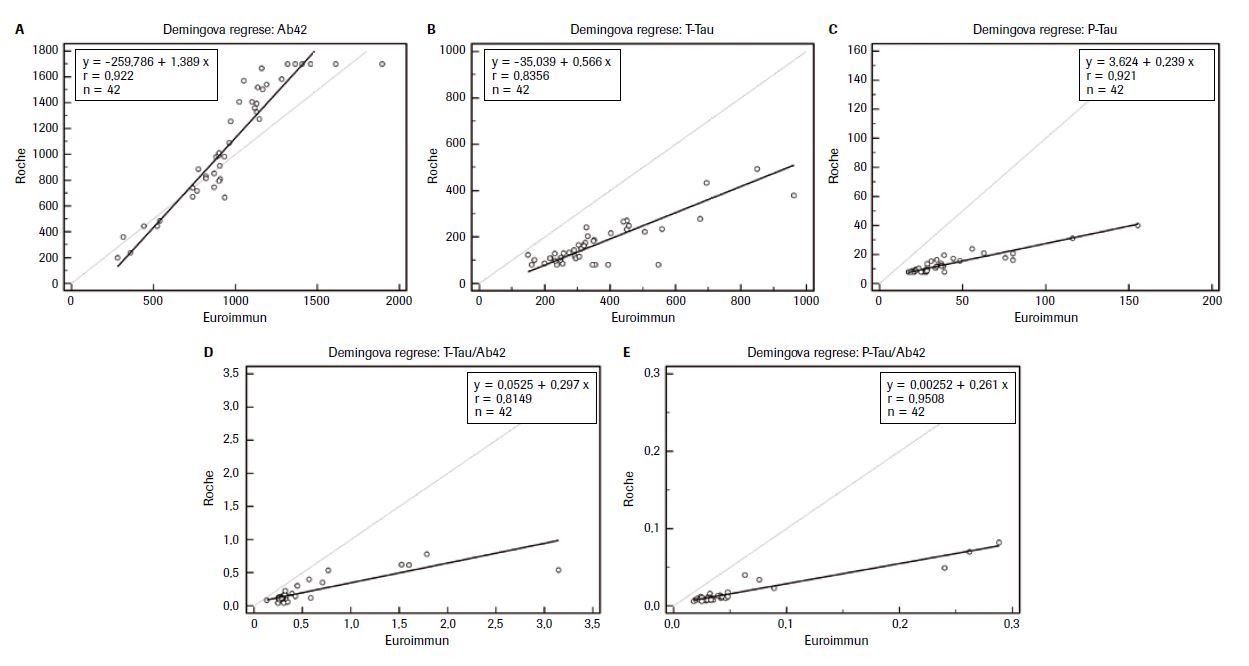
Základní charakteristiku studovaného souboru uvádí tabulka 1. Absolutní hodnoty obou testovaných analytických platforem se výrazně lišily, nicméně korelační analýza mezi studovanými biomarkery prokázala statisticky významné korelace mezi metodami Ab42 (Roche) vs. Ab42 (EI), resp. P-Tau (Roche), mezi Ab42 (EI) vs. P-Tau (Roche), mezi P-Tau (Roche) vs. P-Tau (EI), T-Tau (Roche) vs. T-Tau (EI), mezi P-Tau (EI) vs. T-Tau (Roche), resp. T-Tau (EI), a mezi T-Tau (Roche) vs. T-Tau (EI), P ≤0,001. Při porovnání jednotlivých biomarkerů pomocí Demingovy regrese byla mezi nimi zjištěna výrazná proporcionální chyba, u Ab42 40 %, T-Tau 43 % a P-Tau 46 %, což je možné vysvětlit odlišným principem stanovení, viz tabulka 2, obrázek 1. Existence výrazných rozdílů mezi jednotlivými diagnostickými soupravami vyplynula rovněž ze vzájemného porovnání jednotlivých dvojic biomarkerů provedeného pomocí metody diferenčních grafů dle Bland-Altmana, viz tabulka 3, obrázek 2. Ve všech diferenčních grafech byl navíc pozorován statisticky významný lineární trend nárůstu diferencí v závislosti na koncentraci daného biomarkeru ve vzorku. Tento trend samozřejmě ovlivňuje validitu výpočtu rozdílu (biasu) mezi jednotlivými metodami. Současně bylo zjištěno, že s rostoucí koncentrací T-Tau průměrná odchylka (BIAS) klesá, nicméně v celém rozsahu koncentrací je záporná, v případě P-Tau záporný BIAS s rostoucí koncentrací roste, kdežto u Ab42 je u nízkých koncentrací záporný BIAS, s rostoucí koncentrací Ab42 průměrná odchylka vzrůstá, tj. vykazuje kladný BIAS. Při porovnávání diferencí mezi měřenými biomarkery vzhledem k celkové analytické chybě měření (TEa = ±25 %) vycházející z hodnocení externí kontroly kvality společnosti Instand bylo zjištěno, že metody jsou z klinického pohledu vzájemně nezaměnitelné. Rozložení naměřených hodnot neurodegenerativních markerů v závislosti na diagnóze a použité metodě stanovení (EI vs. Roche) lze pozorovat na obrázku 3.
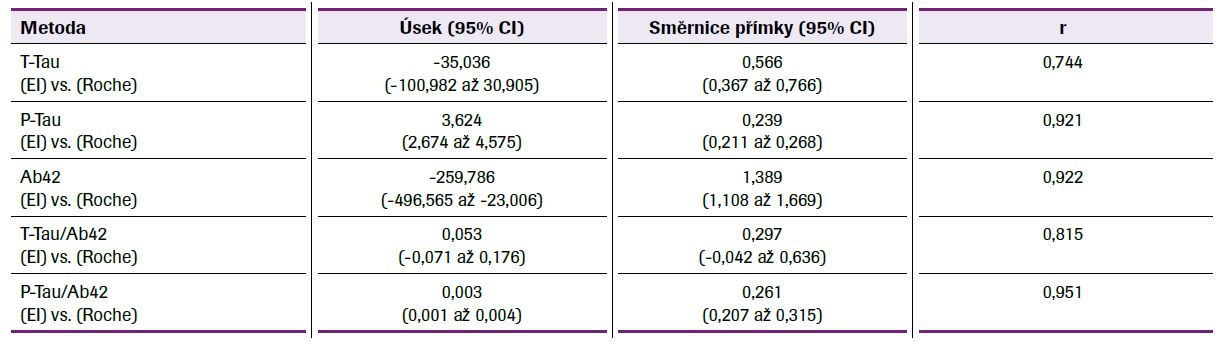
Dále z důvodu rozdílných referenčních intervalů byla pro porovnání metod na základě shody klinické interpretace použita Kappa statistika. Kvantitativní výsledky měření získané odlišnými metodami stanovení bylo nutné převést pomocí referenčních hodnot používaných pro danou metodu na kvalitativní výsledky (negativní/pozitivní). Nejvyšší kappa koeficient, resp. velmi dobrá shoda mezi testovanými metodami byla prokázána u T-Tau (κ = 0,844), dostatečná shoda pak mezi P-Tau metodou EI a Roche (κ = 0,465) a slabá shoda mezi Ab42 metodou EI a Roche (κ = 0,286), viz tabulka 4.
Diskuse
Neurodegenerativní onemocnění vznikají v důsledku progresivní degenerace nebo postupného zániku specifických skupin neuronů. Jejich patofyziologickou podstatou je střádání specifického proteinu pro dané onemocnění v mozkové tkáni v kombinaci s obecnými mechanismy apoptózy a autofagie.12,13 V naší studii jsme se zaměřili na beta-amyloid 42, celkový tau protein a fosforylovaný tau protein (181P) a jejich stanovení dvěma odlišnými metodami. Stanovení diagnostickými soupravami firmy Roche vyžaduje přísné dodržování preanalytických podmínek, jako je odběr předem daného množství likvoru definovaným způsobem do specifických odběrových zkumavek a jeho další zpracování (použití konkrétních špiček, mikrozkumavek atd.) a uchování při teplotě -60 °C nebo nižší minimálně po dobu 3 dnů do doby analýzy.14,15,16 Oproti tomu stanovení diagnostickými soupravami firmy Euroimmun vyžaduje odběr do polypropylenových zkumavek bez další specifikace typu odběrových zkumavek, špiček, alikvotačních zkumavek a doby zamražení před analýzou.17,18,19 Podobné informace lze získat i od autorů Bartoš a spol.,20 kteří ve své práci popisují praktické informace k vyšetření likvorového tripletu. Z práce vyplývají i další podstatné informace týkající se transportu vzorku bez nutnosti chlazení či zamražení vzorku, pokud je CSF dopraven do 6 dnů od odběru. Při delší časové prodlevě pak doporučují vzorek CSF zamrazit a skladovat při teplotě -15 až - 25 °C, pro dlouhodobé skladování zamražení na - 80 °C.
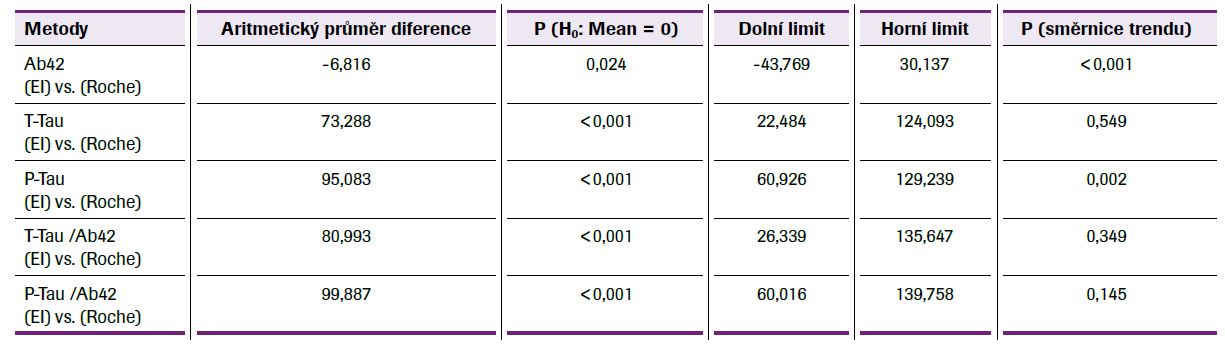
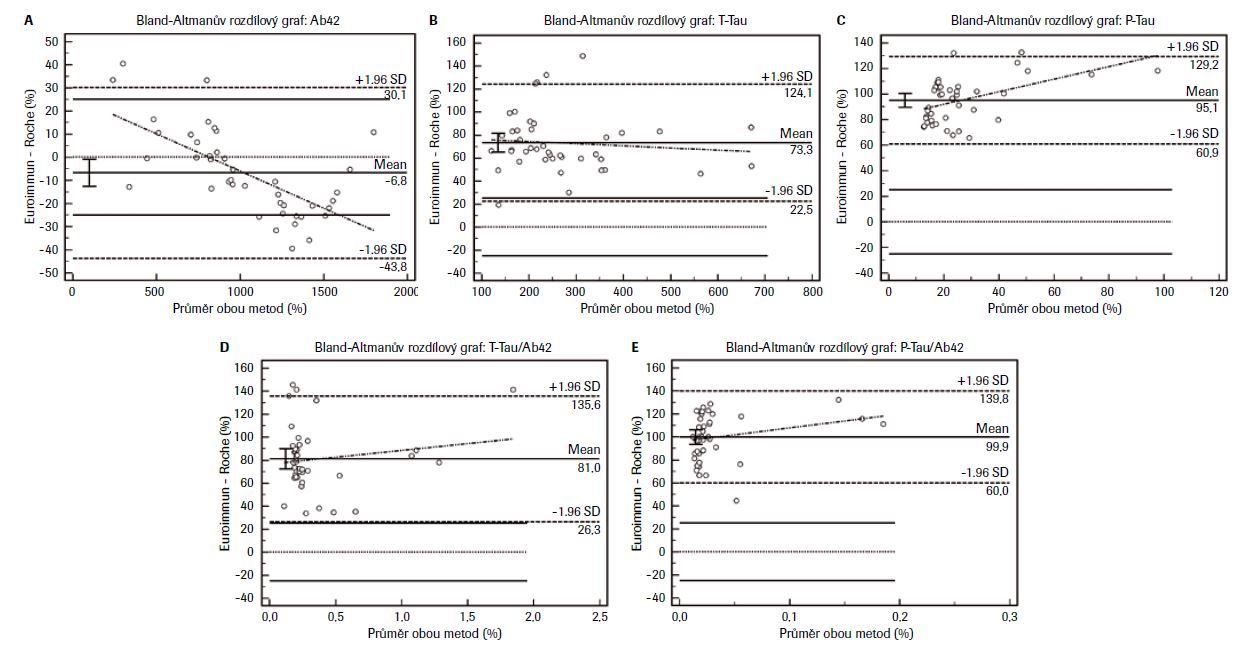
celkové povolené chybě ±25 %
Vlastní stanovení neurodegenerativních biomarkerů již probíhá zcela standardně při použití obou diagnostických souprav. Nicméně diagnostické soupravy firmy Roche lze použít ke stanovení neurodegenerativních markerů kdykoliv bez ohledu na množství vzorků přijatých laboratoří k analýze na rozdíl od ELISA metody, kde by se rozhodně nevyplatilo provádět analýzu při počtu vzorků menším než 8. V konečném důsledku, při malém počtu vzorků, by se stala ELISA metoda cenově náročnější než plně automatizovaná metoda na analyzátoru ROCHE, která má však vyšší vstupní cenu. Při porovnání výše jmenovaných diagnostických souprav byly pozorovány v absolutních koncentracích výrazné rozdíly mezi testovanými biomarkery, nicméně testy spolu dobře korelovaly. V případě T-Tau a P-Tau bylo dále zjištěno, že diagnostické soupravy firmy Roche poskytují nižší hodnoty než diagnostické kity firmy Euroimmun, zatímco v případě Ab42 diagnostické soupravy firmy Roche poskytují při nižších koncentracích nižší hodnoty, naopak při vyšších koncentracích vyšší hodnoty.
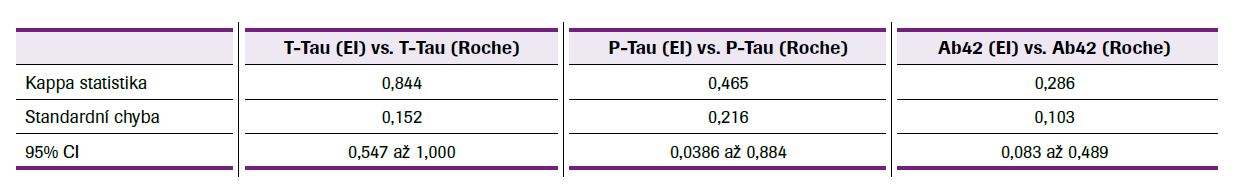
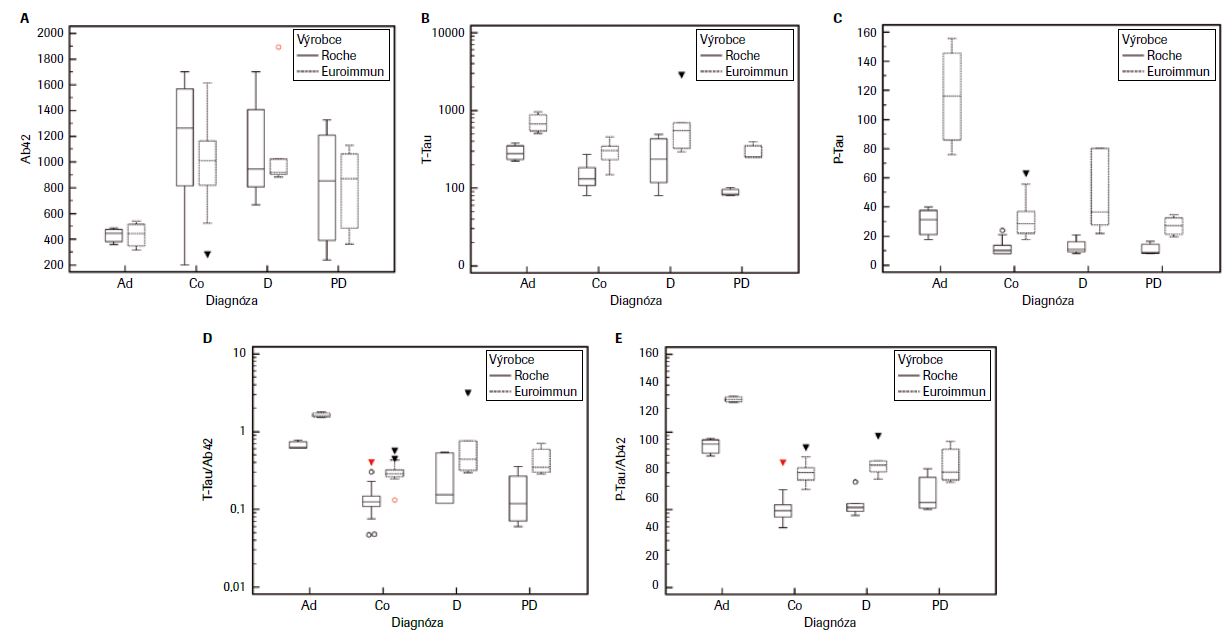
Současně jsme došli k závěru, že použité diagnostické soupravy nelze z klinického hlediska zaměnit, tudíž je při interpretaci nutné přihlížet k referenčním mezím konkrétního výrobce. S podobnými výsledky se setkáváme i v práci autorů Bartoš A. a spol.,20 kteří studovali shodu výsledků likvorového tripletu T-Tau, P-Tau a Ab42 dvěma ELISA metodami, ale podobně jako v naší studii nacházeli u tau proteinu analyzovaného soupravou Euroimmun vyšší koncentrace než u druhé testované soupravy Innotest, zatímco v případě stanovení koncentrace Ab42 soupravou Euroimmun získali nižší koncentrace než soupravami Innotest. Také Fagan A. M. a spol.21 se zabývali porovnáním diagnostických souprav Innotest® ELISA a INNO-BIA AlzBio3. Ačkoli absolutní hodnoty Ab42, T-Tau a P-Tau získané oběma platformami byly odlišné, korelovaly spolu velmi dobře, stejně jako poměr T-Tau/Ab42. Rovněž v souladu s předchozími studiemi22,23 používajícími tyto testy zjistili, že jednotlivé neurodegenerativní markery T-Tau, P-Tau i Ab42 v CSF korelují s kortikální amyloidovou náloží, i když různou měrou. Nicméně poměry T-Tau/Ab42 získané oběma testovanými diagnostickými kity překonaly jednotlivé biomarkery včetně Ab2. Autoři došli k závěru, že obě testovací platformy fungují dobře při identifikaci jedinců s přítomnými amyloidními plaky, zejména poměr T-Tau/Ab42, a dále podporují silný vztah mezi patologiemi amyloidu a celkového tau proteinu u pacientů s AD.
Závěr
Byly prokázány statisticky významné rozdíly mezi jednotlivými metodami stanovení. Diagnostické soupravy firmy Roche a Euroimmun nejsou navzájem zastupitelné. Nicméně uspokojivá shoda z hlediska klinické interpretace byla prokázána mezi všemi testovanými diagnostickými soupravami. Pro rutinní analýzu lze tedy doporučit obě metody stanovení, nicméně je nutné mít stále na paměti sledování hladiny příslušných biomarkerů ve stejné laboratoři používající stále stejnou metodu stanovení a hladinu konkrétního biomarkeru interpretovat vzhledem k referenčním mezím konkrétní laboratoře. Za pozitivní nález je pak vždy považován nález patologických koncentrací minimálně dvou testovaných parametrů.