Neonatologie zaznamenala za poslední desetiletí obrovský pokrok, a to převážně v péči o předčasně narozené novorozence. Co však zůstává stále palčivým problémem a tématem mnoha výzkumných skupin, je novorozenecká sepse. Péče o předčasně narozené novorozence se soustřeďuje do perinatologických center (v ČR 12), je to tedy okruh velmi úzký. Avšak se septickým novorozencem se setkává i lékař pracující na oddělení fyziologických novorozenců. V tomto článku uvádíme přehled běžně užívaných laboratorních markerů. Druhou část sdělení věnujeme novým možnostem diagnostiky sepse.
Úvod
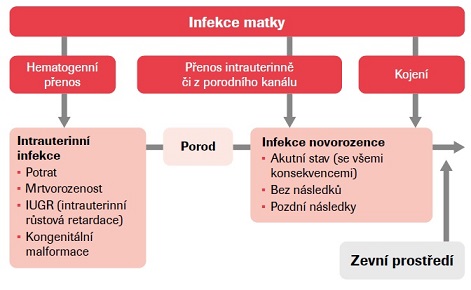
Novorozeneckou sepsi dělíme na časnou, tzv. early-onset sepsis (EOS), a pozdní, tzv. late-onset sepsis (LOS). EOS je definována jako sepse, která vznikla přestupem bakterií vertikálně z matky na dítě před porodem nebo během něj a objeví se do 72 hodin od porodu. Naproti tomu pozdní sepsi definujeme jako sepsi vzniklou až po 72 hodinách života novorozence a je způsobena patogeny získanými během porodu či častěji „díky“ pobytu dítěte v nemocnici1 Včasná diagnostika a zahájení terapie rozhodují zásadním způsobem o osudu dítěte. Novorozenecká sepse je důležitou příčinou morbidity a mortality novorozenců. Klasická definice sepse se opírá o výskyt klinických příznaků zánětlivé reakce organismu (SIRS) a průkaz patogenní bakterie v krevním vzorku (pozitivní hemokultura). Interpretace výsledků je však komplikovaná (viz níže) a klinické příznaky zánětlivé reakce organismu jsou v novorozeneckém období nespecifické, proto je zapotřebí dalších laboratorních diagnostických nástrojů.
Laboratorní markery sepse – běžně využívané
Hemokultura
Zlatým standardem v diagnostice sepse je průkaz původce z hemokultury. Jak již bylo řečeno, u novorozence je interpretace výsledků mnohdy složitá. Výsledek nemáme k dispozici dříve než za 24 či 48 h. Výtěžnost vyšetření klesá kvůli častému antenatálnímu podání ATB matce, technickým potížím či malému množství odebraného vzorku. Minimální požadované množství by mělo být 1 ml, ideálně 2 ml, což v případě novorozence není množství zanedbatelné.2
C-reaktivní protein
autor sonorileto, zdroj: Shutterstock
C-reaktivní protein (CRP) je syntetizován játry a patří mezi tzv. proteiny akutní fáze. Je to nejčastěji používaný laboratorní marker infekce. V porovnání s ostatními markery sepse je levný a běžně dostupný ve všech nemocnicích. Interpretace hodnoty CRP v akutní fázi infekce je ale sporná. CRP není vhodným markerem pro včasnou diagnostiku časné novorozenecké sepse, je však vhodný k monitoraci léčby, jelikož jeho hladina klesá po eradikaci infekčního stimulu.3 Stimulem pro vyplavení CRP je interleukin-6.4,5 Bender a kol. ve své studii z roku 2008 uvádějí, že medián maximální hladiny CRP je po infekčním stimulu 16–24 h, a zároveň zjistili, že CRP začne stoupat v době, kdy sérové hladiny IL-6 již klesají.6 Je to také marker nespecifický – zvýšené koncentrace CRP byly pozorovány i u neinfekčních stavů, jako je aspirace mekonia, nekróza tkáně, ale i po operaci.7,8
Prokalcitonin
Prokalcitonin (PCT) je peptid, který je kódován CALC-1 genem lokalizovaným na chromozomu 11, a je prekurzorem kalcitoninu. Bakteriální infekce má za následek zvýšení exprese CALC-1 a následné uvolnění prekurzorů kalcitoninu ze všech tkání a buněk.9 Prokalcitonin je využíván k diagnostice bakteriálních infekcí a k hodnocení prognózy septických onemocnění. V diagnostice časné novorozenecké sepse je však hlavním úskalím jeho fyziologické zvýšení v prvních hodinách a dnech života. Nejvyšších fyziologických hodnot dosahuje mezi 18. a 30. hodinou života a k poklesu na obvyklé hodnoty dochází až během 48 hodin.10,11 V diagnostice pozdní novorozenecké sepse patří PCT svou dynamikou mezi střednědobé laboratorní markery infekce, jeho reakce je tedy rychlejší ve srovnání s CRP a také rychleji reaguje na úspěšnou ATB léčbu infekce.12 Hladina PCT koreluje s tíží infekce, není ovlivněna virovými infekty.13,14 Při zohlednění fyziologického postnatálního vzestupu je PCT dobrým a poměrně specifickým markerem bakteriální infekce v novorozeneckém věku. Stanovení PCT má ve své nabídce již většina laboratoří a výsledky jsou k dispozici ve statimovém režimu. PCT se stanovuje imunochemicky s vysokou přesností a citlivostí, cena vyšetření je oproti CRP více než desetinásobná.
Interleukin-6
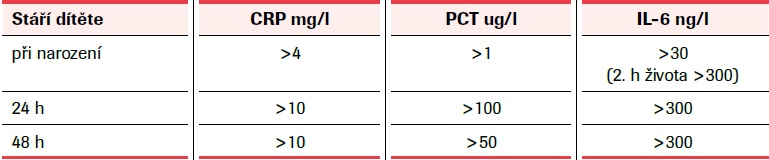
Dalším proteinem akutní fáze využívaným v rámci časné diagnostiky novorozenecké sepse časné i pozdní je interleukin-6 (IL-6). IL-6 je cytokin, který hraje jednu z hlavních rolí v obraně organismu, a to díky svému imunitnímu a hematopoetickému působení a – jak už bylo řečeno – schopnosti vyvolat odpověď akutní fáze.15 Cytokiny jsou malé molekuly, jejichž poločas v séru jsou minuty až hodiny.16 Jakmile dojde k uvolnění složek bakteriální buněčné stěny, hladina IL-6 rychle vzroste a maximálních hladin dosahuje v řádu několika hodin.17 Jde o velmi časný marker novorozenecké sepse. Vzhledem k jeho krátkému poločasu je již 24 hodin po infekčním stimulu v plazmě téměř neměřitelný a není tedy vhodný k monitorování léčby.18 Překážkou pro dostupnost IL-6 na některých pracovištích zůstává jeho vysoká cena. Dnem 1. ledna 2020 nabyla účinnost vyhláška č. 269/2019 Sb., která mimo jiné přináší zařazení nového výkonu 81301 – Stanovení interleukinu IL6 v lidském séru a plazmě pro odbornost 801 (klinické biochemie). Tím by se měla zlepšit dostupnost IL-6 na některých pracovištích, protože dříve byl výkon vázán pouze na odbornost 813 (alergologie a klinická imunologie). Všechna jmenovaná vyšetření ve FN Olomouc provádíme také z pupečníkové krve. Cut-off hodnoty vyšetření, které používáme v naší nemocnici, jsou uvedeny v tab. č. 1.
Laboratorní markery sepse – „nové“
Existuje celá řada slibných laboratorních markerů sepse. Jejich užití je však zatím koncentrováno převážně do perinatologických center, a to v rámci probíhajících studií.
Kalprotektin
Kalprotektin je členem rodiny S100 proteinů.19 Je to antimikrobiální protein, který se nachází v cytosolu buněk vrozené imunity a uvolňuje se bezprostředně po interakci hostitel–patogen. Pro tuto svou vlastnost se používá jako laboratorní známka aktivace granulocytů a mononukleárů.20 Měření hladiny tohoto S100 proteinu je již rutinně zavedeno např. v gastroenterologii v rámci diagnostiky nespecifických střevních zánětů či v revmatologii pro strategii biologické léčby juvenilní idiopatické
artritidy.21,22,23 Studií zaměřených na diagnostiku novorozenecké sepse je však zatím stále málo. V roce 2011 se Terrin a spol. zaměřili na diagnostiku pozdní novorozenecké sepse. Porovnávali kalprotektin s běžně užívanými laboratorními markery (leukocyty, trombocyty, poměr nezralých a zralých forem neutrofilů, CRP).Sérová koncentrace kalprotektinu byla signifikantně vyšší (p < 0,001) u novorozenců s potvrzenou sepsí oproti novorozencům neinfekčním a zdravým.24 O 4 roky později, v roce 2015, Decembrino a spol. také porovnávali diagnostické možnosti a přesnost již zavedených laboratorních znaků (leukocyty, neutrofily, trombocyty, CRP) a kalprotektinu u novorozenecké sepse (tentokrát nerozlišovali sepsi časnou a pozdní). Data z této studie ukazují, že by kalprotektin mohl být užíván jako časný marker sepse. Jeho sérová hladina není ovlivněna stářím, pohlavím, způsobem porodu či počtem leukocytů.25 Dynamika tohoto proteinu během novorozenecké sepse není zatím detailně prozkoumána, ale z dostupné literatury se zdá, že se jedná o marker pozdní, vhodný spíše pro monitoraci klinického stavu a léčby.
CD64
CD64 je vysoko afinní Fc receptor, tedy receptor, který specificky váže Fc oblast protilátek. Za fyziologických okolností je exprimován převážně monocyty a velmi slabě neaktivními neutrofily.26 Při aktivaci imunitního systému vidíme výrazný nárůst exprese CD64 na neutrofilech, a to do jedné hodiny po invazi bakteriálním patogenem.27 Tento Fc receptor je možné rychle a elegantně detekovat pomocí průtokové cytometrie, kde je zapotřebí velmi malého množství krve, což je v případě nezralého novorozence velkou výhodou.28 Exprese CD64 je u septických novorozenců signifikantně vyšší ve srovnání s neinfekčními pacienty.29,30,31,32,33
Presepsin
Presepsin je solubilní fragment molekuly CD14. CD14 je glykoprotein exprimovaný na membránách makrofágů, monocytů a granulocytů. Fyziologickou funkcí presepsinu je identifikace antigenů bakterií, virů a plísní a spuštění signální dráhy zprostředkované toll-like receptory. Po aktivaci této signální dráhy je CD14 odloučen z buněčné membrány a detekován v krvi.34 Studií zabývajících se presepsinem jakožto možným laboratorním markerem novorozenecké sepse je celá řada, avšak užití v praxi zatím běžné není. Jako u všech „nových“ markerů je třeba detailně prozkoumat jeho dynamiku, stanovit cut-off hodnoty a zjistit jeho chování v prvních hodinách života novorozence.
Diskuse
Základní poučka pediatrie zní, že dítě není malý dospělý. O novorozenci to platí dvojnásob. Novorozenecké období je charakteristické nezralým a rozvíjejícím se imunitním systémem a tím se novorozenec stává vulnerabilnějším vůči infekci. Včasná diagnostika novorozenecké sepse je základním předpokladem pro úspěšnost léčby a outcomu dítěte. Existuje řada klinických i laboratorních znaků novorozenecké sepse. Klinické znaky jsou však převážně u předčasně narozených novorozenců značně nespecifické, proto je třeba využít a hlavně umět správně interpretovat markery laboratorní. Je třeba znát jejich fyziologickou dynamiku a k hodnocení výsledků je nutno přistupovat individuálně.