Historie
Imunohistochemie (IHC) začala pronikat do lidského povědomí během čtyřicátých let dvacátého století. Jedná se o jednu z modernějších metod vycházející z histochemie, která vznikala přibližně od třicátých let dvacátého století. Cílem IHC je lokalizovat a identifikovat chemické látky ve tkáních na histologické nebo cytologické úrovni. Ve čtyřicátých letech dvacátého století se zdařil první průkaz antigenů ve tkáni, od padesátých let se tyto techniky začaly dostávat i do diagnostiky v rámci oboru patologie a postupně byly vylepšovány. V sedmdesátých letech byly připraveny protilátky proti jednomu konkrétnímu epitopu (antigenní determinantě), tzv. monoklonální protilátky. Významné bylo rovněž spojení enzymu s protilátkou, jehož praktické využití vyústilo v širší zavedení IHC do praxe.
IHC je v dnešní době využívána ke specifičtějšímu průkazu látek v preparátech, k upřesnění onkodiagnostiky, k lokalizaci extra- či intracelulárních molekul, enzymů, sekrečních produktů apod. V diagnostické praxi je IHC u řady chorob prakticky nezastupitelná. Specifickou variantou IHC je imunofluorescenční vyšetřovací metoda, která od roku 1960 zaznamenala velké rozšíření a zdokonalení.
Fluorescenční mikroskopie umožňuje zobrazit určité látky obsažené v buňkách často v minimálním množství. Je založena na skutečnosti, že některé chemické látky – fluorofory (známé i pod názvem fluorochromy či fluorescenční barviva) – po dopadu světla o kratší vlnové délce (excitační záření) září světlem o delší vlnové délce (emisní záření), tzn. světlem jiné barvy. Tento jev se nazývá fluorescence a je projevem intramolekulové energetické změny vzbuzené v látce absorbovaným zářením. Podstatou fluorescence je tedy použití vysoce citlivého fluoroforu v kombinaci se specifickou primární protilátkou. Fluoroforem může být malá molekula, například typicky organická sloučenina s aromatickým jádrem, popřípadě protein. Výhodou je vysoká citlivost a možnost pozorovat několik znaků pomocí fluoroforů s rozdílnou emisí. Fluorofor bývá nejčastěji kovalentně připojen k makromolekule, kde ho lze detekovat. Takovými makromolekulami mohou být například protilátky, nukleové kyseliny nebo peptidy. Mezi nejznámější fluorofory patří například fluorescein isothiocyanát (FITC, zelený fluorofor) nebo fluorofory derivované od rhodaminu (TRITC s červenou výslednou fluorescencí), dále fluorofory derivované od kumarinu nebo cyaninu. Nové generace fluo-roforů jsou zpravidla účinnější než tradiční fluorofory se srovnatelnou excitací a emisí. Jsou stabilnější na světle, jasnější a méně pH senzitivní.
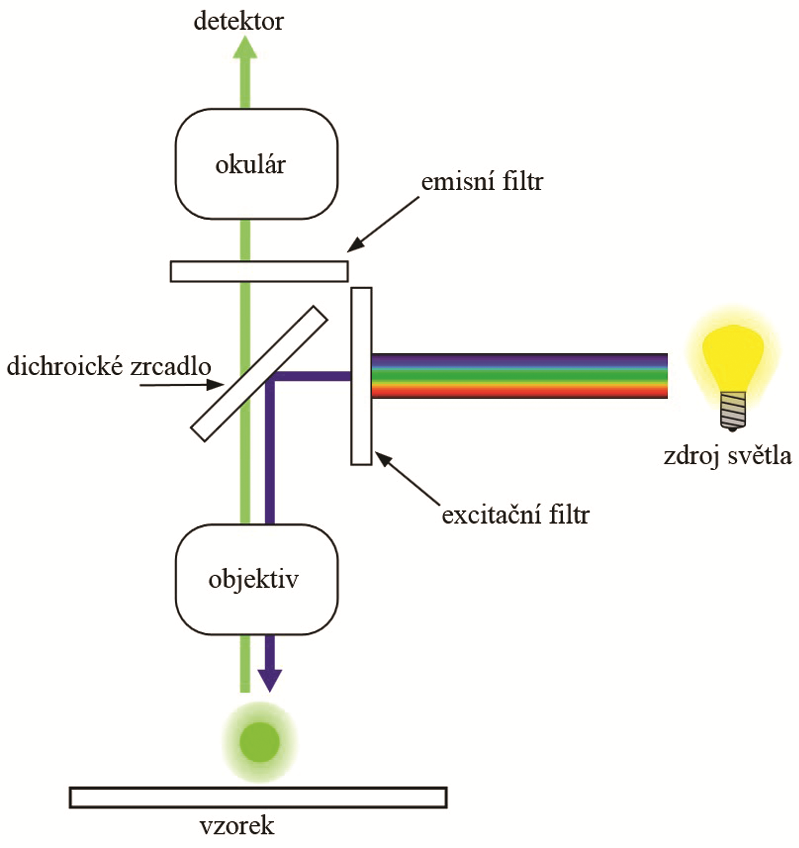
K vyhodnocení výsledků fluorescenčního barvení se používají fluorescenční mikroskopy, které se od světelných podstatně liší vybavením.
Základní součástí fluorescenčního mikroskopu jsou:
Zdroj světla: ze světelného zdroje vychází světlo s různými vlnovými délkami od ultrafialové po infračervenou.
Excitační filtr: tento filtr propouští pouze světlo, které je potřebné k fluorescenci vzorku, obvykle především s kratší vlnovou délkou. Ostatní světlo pohlcuje.
Fluorescenční preparát: vzorky, které za použití fluoroforu reagují na dopadající světlo fluorescencí.
Bariérový filtr: pohlcuje všechno excitační světlo, které nebylo použito k excitaci, a propouští pouze fluorescenční světlo. Navíc je možné z fluorescenčního spektra nechat projít pouze jeho část.
Funkce fluorescenčního mikroskopu je založena na dvou principech:
1. Na vzorek dopadá pouze světlo v intervalu vlnových délek, které způsobují excitaci.
2. K vytvoření obrazu je využita pouze nezbytně nutná část fluorescenčního světla, které obsahuje i neabsorbovanou část excitačního světla. Obraz se buď pozoruje „online“ v mikroskopu, nebo se nafotí a prohlíží pomocí počítače. Volba vlnové délky je velmi podstatná, stejně jako použití vhodných optických filtrů.
A jak to funguje v praxi?
Molekuly protilátky (lépe monoklonální) označené navázaným fluoroforem se specificky vážou s molekulami buněčných a tkáňových antigenů – vznikají komplexy antigen + protilátka + fluorofor. Tyto při použití patřičného filtru v mikroskopu fluoreskují, čímž nám dávají informaci o přítomnosti antigenu v buňce či tkáni.
Imunofluorescenční vyšetření tedy slouží jednak k detekci antigenů v tkáních či buňkách, jednak umožňuje průkaz protilátek. Díky tomu rozlišujeme dva typy IF – přímou a nepřímou.
Přímá imunofluorescence detekuje pomocí značených protilátek antigeny přítomné v buňkách a tkáních.
Nepřímá imunofluorescence informuje o přítomnosti specifických protilátek v séru pacienta. Diagnostika probíhá za použití substrátu (např. opičí jícen), který je nanesen na speciální podložní skla, na nichž dochází k navázání značené protilátky proti sérovým protilátkám pacienta.
Fluorofory jsou navázány na polyklonální nebo monoklonální protilátky, které interferují s antigenem. V praxi se využívají komerčně vyráběné konjugáty – fluoroforem označené protilátky: prasečí imunoglobuliny konjugované FITC proti lidskému imunoglobulinu IgG, IgA, IgM, Ig – polyklonální, proti 3. složce komplementu (C3) a fibrinu, lehkým a těžkým řetězcům (Kappa, Lambda).
Imunofluorescenční metodikou lze provést kompletní diagnostiku imunokomplexových onemocnění i onemocnění, která vzniknou na podkladě tvorby protilátek proti vlastním orgánům, jejich částem a organelám – tzv. autoagresivní choroby. U komplexových onemocnění detekujeme nepřímo imunokomplexy ve tkáních, kapiláry glomerulů u glomerulonefritid, cévy u artritid. Sérologicky v řezech prokazujeme protilátky proti hladké svalovině, mitochondriím, štítné žláze, buňkám žaludeční sliznice, myokardu, bazálním membránám plicních alveolů, glomerulárním bazálním membránám atd. Lze detekovat viry, jejich nahromadění v buňce, jádře, jadérku. Můžeme verifikovat některé bakterie a některé zvláštní proteiny s charakteristickými antigenními vlastnostmi – gliální proteiny, myosin, amyloid a jiné. U nádorů z lymforetikulární tkáně lze detekovat jejich příslušnost k T nebo B řadě.




V naší laboratoři jsme zavedli do praxe imunofluorescenční (IF) vyšetření autoimunitních dermatologických onemocnění za využití přímé fluorescence.
Co se týče technického zpracování kožních biopsií, je nezbytné dodržovat určité zásady odběru a transportu tkáně ke zpracování. V rámci naší laboratorní příručky jsme informovali potenciální odběrová pracoviště o všech nezbytných krocích. Tkáň se ke zpracování do laboratoře transportuje v tzv. nativním, nefixovaném stavu, nikoliv fixovaném ve formolu, jak tomu bývá u standardních biopsií. Abychom mohli garantovat kvalitní výsledek vyšetření, je bezpodmínečně nutné tkáň bezprostředně po odběru uložit na gázu navlhčenou fyziologickým roztokem do transportní uzavíratelné nádobky a následně vložit nejlépe do termosky s chladicím médiem. V žádném případě nesmí být tkáň ponořena do jakékoliv tekutiny (např. fyziologický roztok), mohlo by dojít k poškození tkáně a ztížení diagnostiky. Aby byl výsledek kvalitní, je rozhodující i doba od odběru do zmrazení tkáně. Kůže obsahuje méně enzymů, což umožňuje určitou časovou rezervu, nicméně včasné zmrazení tkáně je pro kvalitu vyšetření nejdůležitějším kritériem.
Laboratoř MDgK-plus zakoupila pro účely rychlého zmrazování tkání – ať už pro fluorescenční vyšetření nebo peroperační biopsie – přístroj PrestoChill. V tomto přístroji zmrazíme tkáň za použití vhodného kryomédia během jedné minuty na teplotu -40 °C. Obrovskou výhodou tohoto postupu je zamezení tvorby krystalů ledu a tím vzniku mrazových artefaktů. Díky tomuto faktu dosáhneme v podstatě stejné kvality kryopreparátu, s jakou se setkáváme při zpracování konvenční histologie u FFPE preparátů (preparáty formolem fixované a zalité do parafínu). Další výhodou je možnost orientace vzorku – po seřezání podložky pod tkání získáme zásluhou techniky „lícem dolů“ rovnou plochu tkáňových struktur.
Dalším krokem je zhotovení kryořezů. Naše laboratoř je vybavena vysoce výkonným kryostatem s intuitivním softwarem a dotykovou obrazovkou pro jednoduchý a efektivní provoz. Komoru lze vychladit na teplotu až -35 °C. Disponuje 27 úložnými pozicemi pro vzorky, integrovaným zařízením rychle ochlazuje na teplotu -55 °C ± 2 °C. Umožňuje zhotovit kvalitní řezy o tloušťce 3–4 µm.
Pro jedno vyšetření zhotovujeme celkem 7 skel, a to systémem postupného prořezání vzorku pro vyšetření IgA, IgG, IgM, C3, fibrinogenu plus 2 skla s volnými řezy jako případnou rezervu.
Skla uložíme do skleněné kyvety, kterou pečlivě obalíme parafilmem a necháme při 4 °C do druhého dne. Poté preparáty barvíme dvojí metodou:
- manuálně – po revitalizaci fyziologickým roztokem aplikujeme protilátku a inkubujeme ve vlhké komoře 60 minut při pokojové teplotě (RT). Následuje 3x 5minutový oplach ve fyziologickém roztoku. Pro kontrast barvíme 1% roztokem Evans Blue (váže se na plazmatické bílkoviny). Skla necháme při RT v temnu úplně uschnout a montujeme médiem pro fluorescenční barvení, které jsme si na našem pracovišti pro tyto účely vyrobili. Jeho výhodou je výrazně vyšší stabilita fluorescenčních barev. Proces barvení trvá cca 2 hodiny.
- automaticky v IHC barvicím automatu Ventana BenchMark Ultra (BMK Ultra) – preparáty revitalizujeme ve 4 °C chlazeným acetonem, opláchneme reagenčním pufrem, opatříme štítky a vložíme do automatu. Barvení fluorescenčním kitem trvá cca 15 minut. Po skončení barvení opláchneme opět pufrem, dobarvíme Evans Blue a důkladně opláchneme reakčním pufrem. Po úplném zaschnutí zamontujeme. BMK Ultra nám poskytuje tu velkou výhodu, že proces je krátký a bez nároků na zásah obsluhy. Další výhodou je, že celý proces barvení probíhá v uzavřeném automatu pod krytem opatřeným tmavým sklem, který fotosenzitivní protilátky maximálně chrání.
Obě metodiky (manuální a pomocí barvicího automatu) jsou v laboratoři MDgK-plus v současné době prováděny paralelně v rámci optimalizace metody a výběru nejvhodnějšího postupu. Po vyhodnocení výsledků za určité období bude vybrán pouze jeden postup, který bude následně používán rutinně.
Dalším způsobem fluorescenčního vyšetření je metoda fluorescenčního vyšetření z FFPE řezů. Má více výhod: jednak si imunofluorescenční vyšetření můžeme indikovat sami pro doplnění nebo upřesnění diagnostiky z preparátů FFPE, jednak pacient nemusí podstupovat opakovaný odběr, protože fluorescenční vyšetření se provede z jeho tkáně odebrané pro histologické vyšetření. A v neposlední řadě odpadá riziko poškození nativní tkáně jejím transportem.
Z parafínových bloků zhotovíme řezy a necháme je do druhého dne sušit v termostatu. Po deparafinaci revitalizujeme PBS pufrem. Demaskování antigenu provádíme enzymaticky. Používáme stejné fluorescenční protilátky jako u kryořezů s inkubací v termostatu. Ke kontrastnímu dobarvení používáme rovněž Evans Blue. Montujeme do média pro fluorescenční barvení. Vzhledem k vysoké fotosenzitivitě fluorescenčních protilátek je důležitou podmínkou eliminace světla během celého barvicího procesu.
Tato metoda je sice časově náročná, ale její přínos je nesporný.
V současné době jsme u nás v laboratoři MDgK-plus začali rovněž testovat metodu vyšetřování sér pacientů pomocí nepřímé imunofluorescence. Tuto metodu nyní zatím používáme pouze pro dermatologickou diagnostiku, tzn. jen s použitím protilátky IgG.
Speciální podložní sklo s 5 vybroušenými jamkami a s adhezivním povrchem (viz obr. 8) se substrátem necháme vytemperovat na RT a následně komůrku s jícnem zaplníme vyšetřovaným sérem zředěným PBS pufrem. Inkubujeme ve vlhké komoře 30 minut při RT. Následuje nejprve důkladný oplach pufrem a poté zalití komůrky pufrem na 5 minut. Dalším krokem je aplikace IgG protilátky ředěné PBS pufrem. Inkubace probíhá 30 minut ve vlhké komoře při RT, tentokrát ve tmě. Po oplachu pufrem dobarvujeme pro kontrast roztokem Evans Blue a po dalším oplachu montujeme do média pro fluorescenční barvení.
Vzhledem k jednoduchosti vyšetření i minimální invazivitě pro pacienta předpokládáme výrazný zájem ze strany kliniků.
IF vyšetření v dermatopatologii se týká především těchto diagnóz:
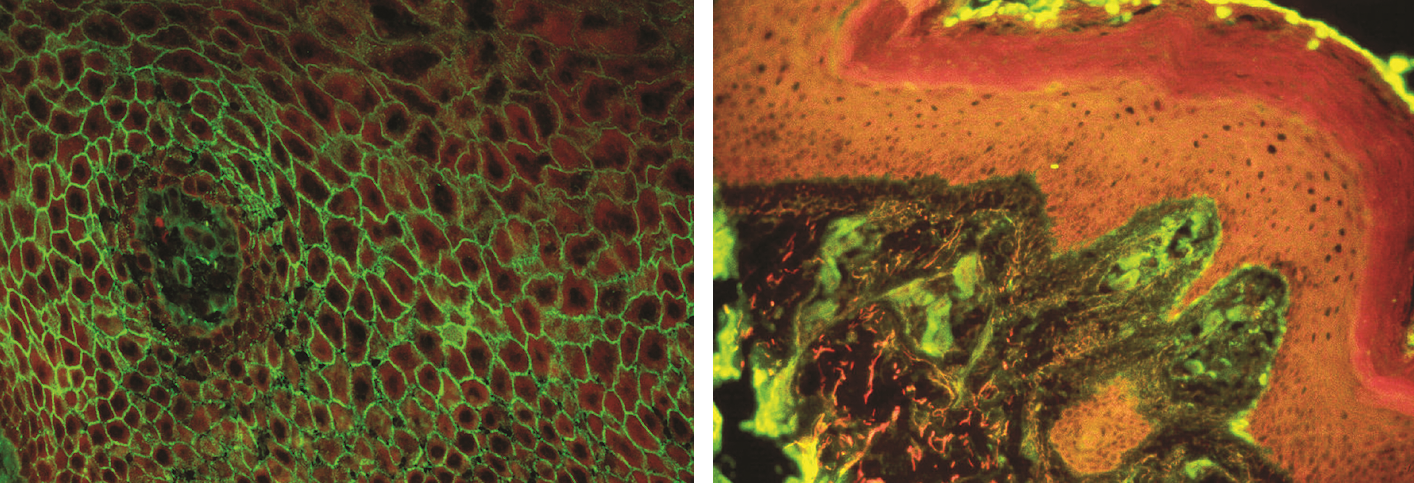
Pemphigus vulgaris – zde se vážou autoprotilátky C3 a IgG v oblasti desmosomů (obr. 9)
Porphyria cutanea tarda – lupusový anti-IgG pruh v junkční zóně a vakovité dilatace cév s depozity IgG, C3 a fibrinu ve stěnách (obr. 10 a obr. 11)
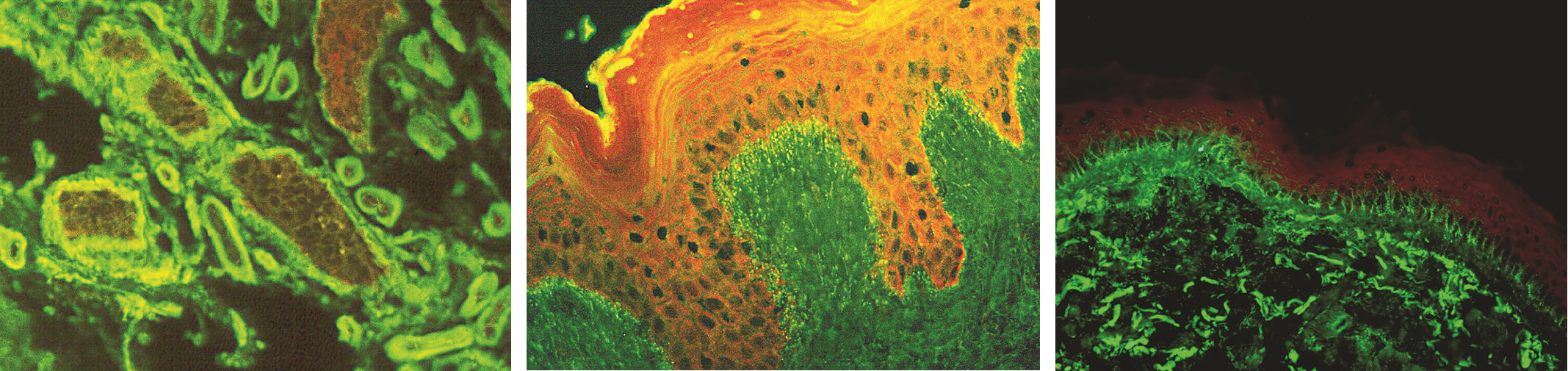
Dermatitis herpetiformis Duhring – IgA protilátky granulárně uspořádané v papilách dermis v sousedství puchýřků (obr. 12)
Lupus erythematosus – přítomnost IgG, C3, IgA a IgM v oblasti dermoepidermální junkce (obr. 13)
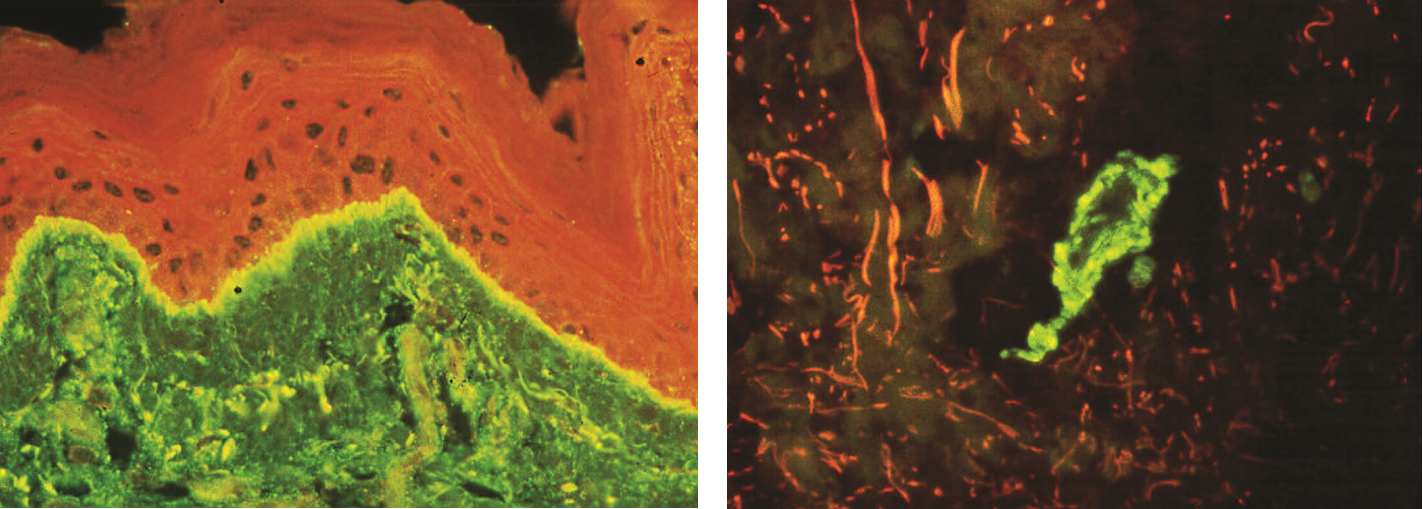
Bulózní pemphigoid – charakterizován přítomností IgG a C3 v oblasti bazální membrány epidermis (obr. 14)
Imunokomplexová vaskulitida – charakterizována depozity protilátek ve stěnách cév (obr. 15)
Obrázky 9–15 pocházejí z Atlasu dermatopatologie: www.muni.cz/atlases