Podle posledních odhadů jsou virem hepatitidy C infikovány přibližně 3 % světové populace. HCV infekce jako nejčastější příčina jaterních onemocnění ve vyspělých zemích světa představuje značné problémy jak terapeutické, tak ekonomické a současně znamená i velkou výzvu pro výrobce diagnostických technologií ke zdokonalení dosavadních testovacích možností.
Virus hepatitidy C (HCV) je malý obalený virus patřící do čeledi Flaviridae. HCV byl identifikován až v roce 1989, přestože již od 70. let minulého století bylo zřejmé, že kromě v té době známých původců hepatidy A a B musí existovat i další virové agens způsobující virovou hepatitidu. Genom HCV je tvořen jednořetězcovou pozitivní RNA, která kóduje nejméně 10 různých proteinů (obr. č. 1), jednak strukturálních (core, E1, E2, p7) a jednak nestrukturálních (NS: NS2, NS3, NS4A, NS4B, NS5A, NS5B).
Virus je charakteristický vysokou variabilitou, v současné době je popsáno 7 základních genotypů, v rámci každého je pak identifikováno několik subtypů. Jednotlivé genotypy se mezi sebou liší v 30–50 % nukleotidových sekvencí a různé subtypy se liší v 15–30 % nukleotidových sekvencí. Infekce HCV se může projevit jako akutní žloutenka typu C, ta je však diagnostikována poměrně vzácně kvůli časté absenci klinických příznaků v akutním stadiu HCV infekce. Studie o přirozeném průběhu HCV infekce dokazují, že 55–85 % pacientů, kteří se infikují virem hepatitidy C, není schopno přirozeným způsobem virus eliminovat a infekce u nich přechází do chronického stadia. U osob s chronickou infekcí HCV významně stoupá riziko rozvoje chronického jaterního onemocnění, jaterní cirhózy (5–20 %) a hepatocelulárního karcinomu (1–2 %).
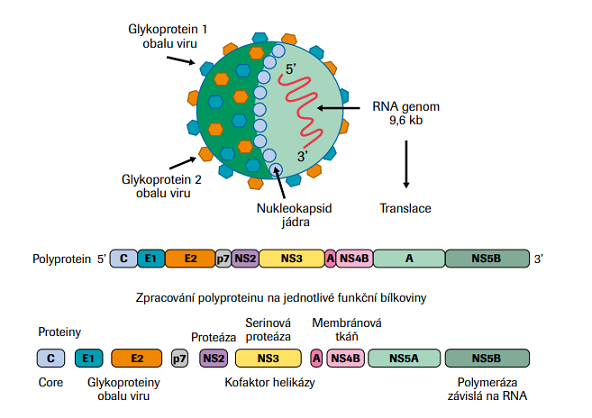
Upraveno dle: https://www.researchgate.net/figure/Hepatitis-C-virus-HCV-model-structure-andgenome-organization-49-a-Model_fig3_320908322
Infekce virem hepatitidy C patří mezi krví přenosné infekce. Hlavními cestami šíření HCV infekce jsou:
- přenos krevními deriváty,
- injekční aplikace drog,
- tetování a piercing neprováděné za aseptických podmínek (zejména amatérsky),
- pravidelné dialyzační léčení (PDL),
- profesionální riziko expozice HCV,
- sexuální kontakt s osobou HCV pozitivní (častější mezi muži, kteří mají styk s muži),
- rodinný kontakt s osobou HCV pozitivní,
- vertikální přenos z HCV pozitivní matky na novorozence (perinatální přenos),
- iatrogenní přenos,
- přenos orgánovým štěpem před rokem 1992.
Před rokem 1992, kdy bylo zahájeno rutinní testování krevních dárců na přítomnost infekce HCV, představovalo hlavní cestu přenosu infekce přijetí infikovaného krevního derivátu. V současnosti je nejběžnější cestou šíření infekce nitrožilní aplikace drog.
Podle údajů Pracovní skupiny pro virové hepatitidy České hepatologické společnosti ČLS JEP a Pracovní skupiny pro virové hepatitidy Společnosti infekčního lékařství ČLS JEP byla v roce 2001 pomocí sérologického přehledu zjištěna prevalence protilátek anti-HCV v běžné populaci ČR přibližně 0,2 %. Na základě údajů o prevalenci a incidenci infekce HCV mezi prvodárci a opakovanými dárci jak v zařízeních transfuzní služby, tak v plazmaferetických centrech (viz tabulka č. 1, č. 2) je v současnosti v běžné populaci toto číslo patrně o něco vyšší.
Testy ke zjištění HCV infekce
Průkaz infekce HCV je založen zejména na sérologických testech, které detekují přítomnost specifických protilátek proti HCV. Protilátky anti-HCV nemají neutralizační efekt, nejsou nositelem imunity organismu. Přetrvávají ve značném titru i u pacientů úspěšně vyléčených. V mezinárodních doporučeních pro diagnostiku a léčbu virové hepatitidy C (AASLD, APASL, EASL, US CDC) jsou uvedeny přehledné algoritmy pro postup testování rizikových osob a požadavky na používané testovací soupravy. Všechna doporučení se shodují v základní ose testovacího procesu, ve kterém po zjištění opakované reaktivity v protilátkových testech následuje konfirmační vyšetření. Pro konfirmaci infekce HCV jsou jednoznačně doporučovány testy založené na detekci HCV RNA v séru nebo v plazmě senzitivními molekulárněbiologickými metodami (doporučení EASL, AASLD, APASL, viz obr. č. 2). Jako testy vhodné pro detekci virové RNA udává doporučení EASL použití technologií s minimální hodnotou dolního detekčního limitu 15 IU/ml. Doporučení EASL současně jako náhradní řešení pro diagnostiku akutní či chronické hepatitidy C v případě nedostupnosti vhodných systémů pro NAT konfirmaci uvádí možnost testovat přítomnost core antigenu HCV. Současně však zdůrazňuje nižší senzitivitu testů detekujících core antigen HCV ve srovnání s NAT technologií (detekční limit pro testy core antigen HCV odpovídá zhruba 500–3 000 IU/ml RNA).
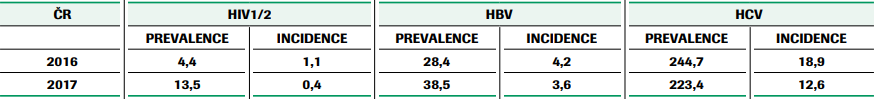
Upraveno dle: Zpráva zařízení transfuzní služby v České republice v roce 2016, 2017 (pro MZ ČR).
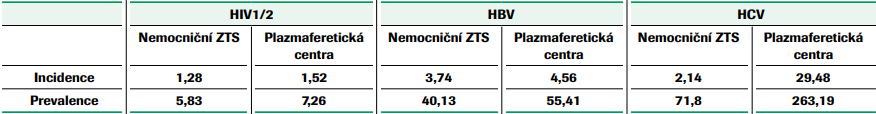
Upraveno dle: Turek, P., Masopust, J. Transfuze Hematol. dnes, 20, 2014, No. 4, p. 125–135.
Testování HCV u dárců krve
V případě testování dárců krve je v současnosti jako povinný test legislativně vyžadován pouze sérologický průkaz protilátek anti-HCV. Vzhledem k délce diagnostického
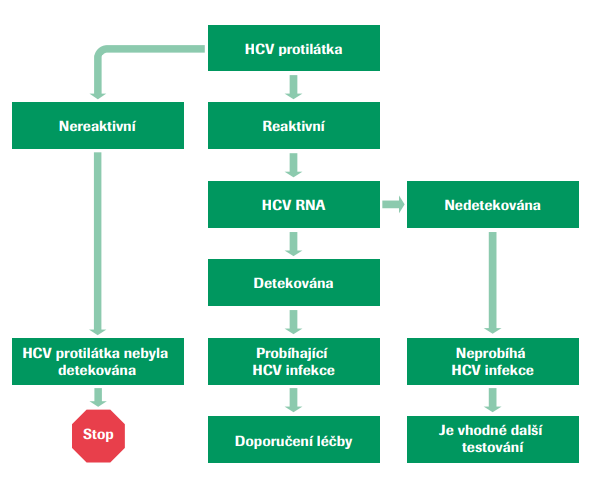
Upraveno dle: AASLD, https://www.hcvguidelines.org/evaluate/testing-and-linkage
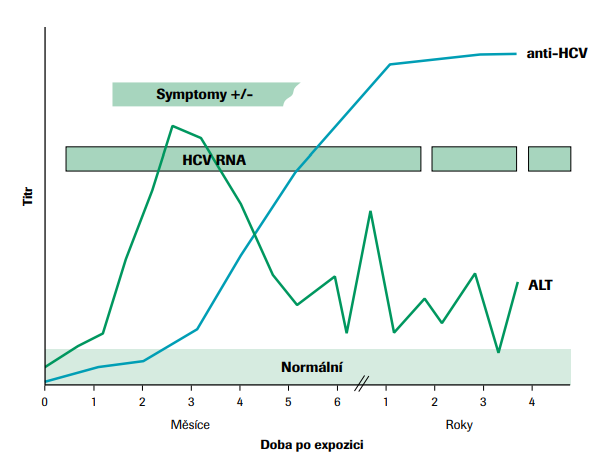
okna (obr. č. 3) je však uvedený test relativně málo spolehlivý na to, aby zaručil bezpečnost krevních přípravků a krevních derivátů. V současnosti používané diagnostické sety tzv. třetí generace výrazně zkrátily délku diagnostického okna ve srovnání s testy první a druhé generace, přesto je délka diagnostického okna odhadována na průměrně 66 dnů.
V řadě zemí se proto přistoupilo k provádění doplňujících testovacích strategií, které mohou bezpečnost spojenou s transfuzními přípravky zvýšit. Jednoznačně nejvyšší výpovědní hodnotu mají testy identifikující přítomnost virové RNA v krevním vzorku dárce (Marwaha and Sachdev, 2014). NAT metody se vyznačují vysokou analytickou senzitivitou vůči HCV RNA a v nastavení ID-NAT mohou detekovat RNA již v koncentraci 2–9,4 IU/ml v rozmezí 4–9 dnů po infekci v závislosti na citlivosti použitého testu.
Některá transfuzní pracoviště místo NAT screeningu virové RNA provádějí testy zjišťující přítomnost jednoho ze strukturálních antigenů HCV, core antigenu. HCV core antigen v séru nebo v plazmě je markerem replikace HCV. Core antigen se v krvi infikované osoby objevuje podstatně dříve, než jsou detekovatelné protilátky (obr. č. 4). Ve srovnání s možností detekce virové RNA je antigen přítomen v krvi infikované osoby jen o 2–8 dnů později. Mohlo by se tedy zdát, že použití testů odhalujících přítomnost core antigenu sérologickými metodami může nahradit nákladnější a časově náročnější NAT metody. Citlivost těchto testů je však výrazně nižší ve srovnání s NAT vzhledem k přítomné virové náloži v časné fázi infekce (viz obr. č. 5).
Pokud můžeme srovnat technologie používané pro průkaz infekce HCV, je zřetelné, že NAT postupy zajišťují jednoznačně nejvyšší senzitivitu testu a současně jsou schopny prokázat i velmi časnou infekci (viz tab. č. 3).
Porovnání testů pro HCV antigen a NAT
Upraveno dle: https://accessmedicine.mhmedical.com/content.aspx?bookid=2268§ionid= 176083301
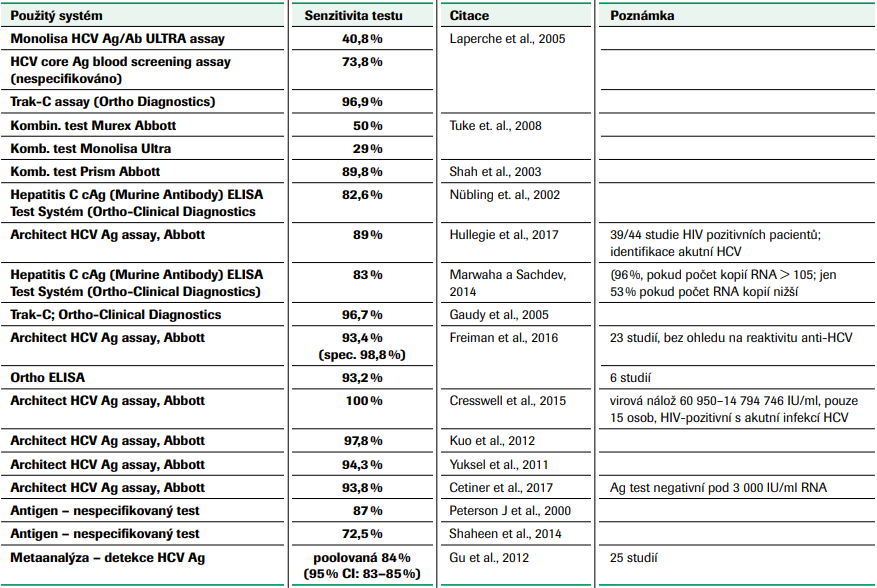
Detekce antigenu může být podle mezinárodních doporučení použita jako náhradní test pro potvrzení diagnózy akutní nebo chronické HCV. Ve srovnání s NAT RNA testy jsou však testy založené na detekci přítomnosti antigenu méně citlivé (dolní limit detekce antigenu odpovídá zhruba koncentraci RNA HCV 500–3 000 IU/ml, v závislosti na genotypu viru), mohou tedy vést k falešně negativním výsledkům zejména v případě screeningového testování dárců krve, obzvláště v časné fázi infekce s nízkou virovou náloží. Diagnostické sety pro identifikaci core antigenu jsou založeny buď na identifikaci samotného antigenu, nebo se jedná o kombinované testy, které současně detekují jak antigen, tak anti-HCV protilátky (tzv. testy čtvrté generace). Byla provedena celá řada studií, které porovnávaly výkonnost metod detekujících core antigen, ať již samotný, nebo v kombinaci s anti-HCV protilátkami, s metodami NAT (tabulka č. 4).
Z údajů uvedených v tabulce č. 4 je zřejmé, že kombinované testy mají výrazně nižší senzitivitu ve srovnání s testy detekujícími samotný antigen. Např. při použití soupravy Monolisa HCV Ag/Ab ULTRA assay byla potvrzena infekce HCV pouze ve 40,8 % případů HCV-RNA pozitivních vzorků. Pokud byl na stejné skupině vzorků použit test detekující pouze HCV core antigen, senzitivita stoupla na 73,8 %, resp. 96,9 % pozitivních výsledků (Laperche et al., 2005). V další studii tento test dosáhl senzitivity pouhých 29 %, přičemž v některých falešně negativních případech se virová nálož vzorku pohybovala nad hodnotou 106 IU/ml (Tuke et al., 2008). Test Monolisa vykázal také výraznou závislost na testovaném genotypu (genotyp 3 – žádný pozitivně identifikovaný vzorek z celkem 15 NAT-HCV pozitivních). Z těchto výsledků jasně vyplývá, že kombinované testy rozhodně nejsou kvůli své nízké senzitivitě spolehlivým řešením pro screening dárců krve a krevních složek.
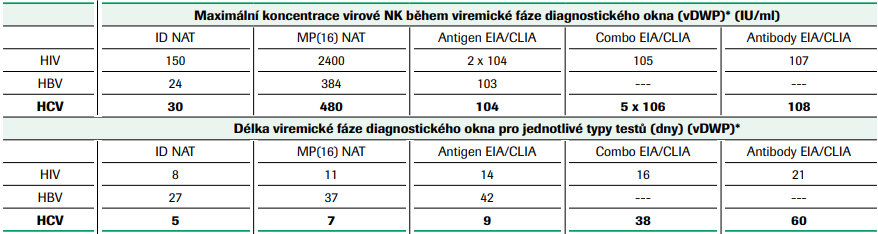
* vDWP = viremická fáze diagnostického okna – je definována jako období s virovou koncentrací ≥ 1 virová částice v erytrocytární transfuzní jednotce obsahující 20ml plazmy; 1 virová částice odpovídá 1 (HCV, HBV) nebo 2 (HIV) genomovým virovým kopiím. 1 IU HCV-RNA odpovídá 4 genomovým kopiím HCV-RNA, 1 IU HBV-DNA 5 genomovým kopiím HBV-DNA a 1 IU HIV-1 RNA 0,5 genomové kopie HIV-1 RNA.
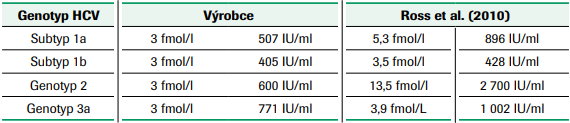
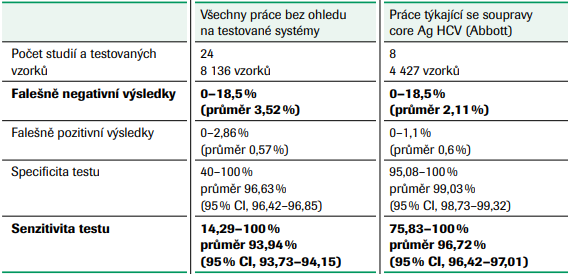
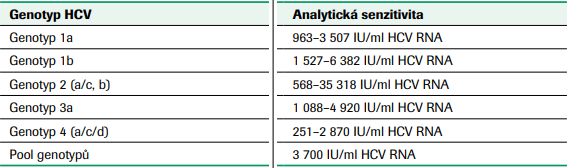
V přehledné práci Hanse Tillmanna (2014) jsou shrnuty závěry některých studií porovnávajících senzitivitu a specificitu testů detekujících HCV core antigen. Nejvíce pozornosti věnuje studiím pracujícím se soupravou, která je v současné době pro testování HCV core antigenu nejčastěji používána (Architect HCV Ag assay, Abbott). Kromě jiného cituje práci Rosse (2010), v níž jsou uvedeny výsledky ověření analytické senzitivity tohoto testu (viz tabulka č. 5). V další souhrnné studii Khan et al. (2017) srovnával celkem 24 prací, které hodnotily analytickou a klinickou výkonnost testů pro detekci core antigenu HCV (viz tabulka č. 6). Z velkého rozptylu hodnot senzitivity testů vyplývá, že pro screening dárců krve a konfirmaci reaktivních výsledků není tato strategie optimální. Nižší senzitivita testu je kromě virové nálože v ověřovaných vzorcích také velmi ovlivněna variabilitou virového genomu (viz tabulka č. 7, Ottiger et al., 2013).
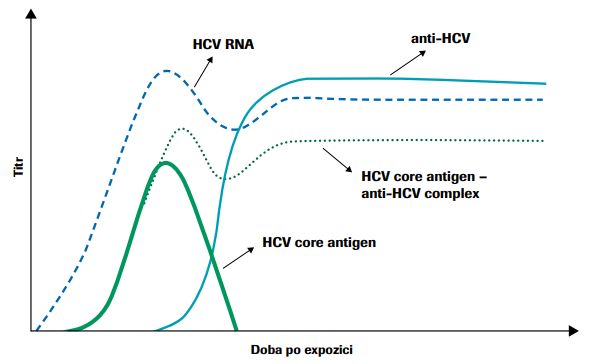
Upraveno dle: https://www.sciencedirect.com/science/article/pii/S1386653204002914 (Seme et al., 2005).
Je nutné si vždy uvědomit, že při interpretaci výsledků testů citovaných v různých publikacích a studiích je nutné postupovat s ohledem na používaný testovací systém pro virovou RNA a jeho hodnotu LLoD. V případě, že je použitý test s vysokou hodnotou LLoD, hodnota specificity a senzitivity testu core Ag HCV může být vyšší ve srovnání s pracemi, které srovnávaly výkonnost se soupravou pro detekci RNA s nižší LLoD. Senzitivita testu pro detekci antigenu je také ovlivněna množstvím přítomných HCV protilátek ve vzorku, které mohou interferovat s detekcí antigenu a mohou tak snížit senzitivitu testu pro detekci antigenu (např. Reddy et al., 2006, senzitivita pouze 14 %).
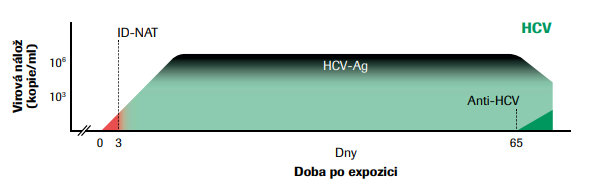
Upraveno dle: Kleinman et al., 2009.
Při implementaci testů detekujících přítomnost virové RNA je důležité brát v úvahu fakt, že koncentrace virových partikulí klesá a významně kolísá u infikovaných osob po sérokonverzi nebo během remise a při chemoterapii. Může tedy dojít k tomu, že při použití minipool strategie (MP16 a více) může být vzorek NAT negativní, ale v sérologických testech prokazujících přítomnost protilátek pozitivní (Roth et al., 2012). Z toho je zřejmé, že sérologické a NAT testy jsou navzájem komplementární a nelze je navzájem nahradit. Z uvedených dat je patrné, že přestože testy detekující core HCV antigen přinášejí výrazné zkrácení diagnostického okna oproti testům anti-HCV, nezajišťují dostatečnou senzitivitu z hlediska požadavků kladených na vyšetřování dárců krve. Pro zařízení transfuzní služby je testování antigenu sice možnou alternativou, nicméně jde o alternativu méně spolehlivou, a proto je namístě preferovat metody s vyšší citlivostí, tedy NAT technologie, které jsou díky své senzitivitě dalším významným pokrokem v zajištění bezpečnosti krevních přípravků.