Kryokonzervace je dosud jedinou metodou umožňující dlouhodobé skladování krve. Kryokonzervované erytrocyty nacházejí uplatnění v bance vzácných erytrocytů, strategické krevní bance pro účely krizové krevní politiky státu a ve vojenském zdravotnictví.
Úvod
V České republice je banka kryokonzervovaných erytrocytů v rutinním provozu od roku 2006 na Oddělení hematologie a krevní transfuze ÚVN Praha. Pro zmražení jsou používány erytrocyty deleukotizované, získané dvojitou erytrocytaferézou nebo z plné krve. Krvinky jsou zmraženy po přidání 40% glycerolu při -80 °C a následně skladovány při -65 °C a méně. Glycerolizace a deglycerolizace jsou prováděny pomocí uzavřeného automatického systému Haemonetics ACP-215 a rozmražené erytrocyty jsou resuspendovány v roztoku AS-3 (Nutricel) s dobou použitelnosti 21 dní po rozmražení nebo v roztoku SAG-M s dobou použitelnosti 7 dní po rozmražení. Doba použitelnosti erytrocytů ve zmraženém stavu je ve znění doporučení Rady Evropy „10–30 let podle použité metody“ 1, ovšem bez dalšího upřesnění. Obvyklou praxí v zemích EU je doba použitelnosti kryokonzervovaných erytrocytů ve zmraženém stavu 30 let, v USA regulace FDA stanovuje 10 let. Důvodem je v prvé řadě forenzní problematika, která vychází z předpokladu, že v době zmražení a uskladnění erytrocytů byl (mohl být) nižší standard a méně vyspělá technologie vyšetřování dárců krve na krví přenosné infekce. V souvislosti s desetiletým výročím provozu banky kryokonzervovaných erytrocytů jsme provedli kontrolní studii kvality dlouhodobě skladovaných erytrocytů, navazující na naše předchozí zkušenosti z prováděné validace v letech 2003–2005 2,3,4,5. Kromě běžných laboratorních vyšetření, jako jsou parametry krevního obrazu, pH, draslík a fosfor, bývají obvykle součástí in vitro hodnocení vitality erytrocytů hodnoty ATP a 2,3-DPG.
Energetický metabolismus erytrocytů
Erytrocyty nepodléhají oxidativní fosforylaci a neukládají glykogen. Musí tedy k získání energie neustále odbourávat glukózu z krevního řečiště přes Embden-Meyerhofův cyklus, který je hlavním zdrojem ATP, 2,3-difosfoglycerátu (2,3-DPG) a redukované formy nikotinamidadenindinu-kleotidu (NADH) v erytrocytu. Většina energie je v erytrocytech vytvořena právě přes tento cyklus a následně uložena ve formě ATP nebo glutationu
či pyridinových nukleotidů (NADH a NADPH). Touto cestou se metabolizuje asi 90 % z erytrocytární glukózy. Hodnoty ATP a 2,3-DPG slouží jako markery vitality a funkčnosti erytrocytu 6.
Adenosintrifosfát (ATP)
Jedná se o nukleosidtrifosfát tvořený adenosinem a trojicí fosfátů navázaných na 5' uhlíku. Jeho význam pro funkci všech známých buněk spočívá v uvolnění energie při rozkladu ATP na ADP a P, která je následně využita téměř ve všech typech buněčných pochodů, včetně proteosyntézy a vnitrobuněčného a membránového transportu 7. Fyzikálně-chemické vlastnosti ATP se podobají vlastnostem jiných nukleotidů. Jedná se o bílou práškovitou látku rozpustnou ve vodě, s několika záporně nabitými skupinami 8. Absorbuje záření v ultrafialové oblasti kolem 260 nm 8. Většina ATP se v těle mnohobuněčných organismů vyskytuje vnitrobuněčně, jen zanedbatelné množství ATP se nachází i mimo vlastní buňky v extracelulárním prostoru. Koncentrace ATP v buňkách se liší podle tkáně, je často kolísavá, průměrně však je 1–10 mmol/litr (mM) 9,10. Mimo buňku se ATP vyskytuje v tkáňovém moku či v krvi, zpravidla v důsledku poranění či apoptózy, ale i fyziologicky. Extracelulárnímu ATP se připisuje řada fyziologických rolí 11.
2,3-difosfoglycerát (2,3-DPG)
Je meziproduktem glykolýzy a erytrocyty ho obsahují velké množství. Váže se na ß řetězce deoxyhemoglobinu, stabilizuje jej a tak snižuje afinitu k O2. Na schopnost vázat kyslík působí řada faktorů – pH, parciální tlak oxidu uhličitého, teplota a 2,3-DPG. Při poklesu pH, vzestupu parciálního tlaku oxidu uhličitého, vzestupu teploty a vzestupu 2,3-DPG se snižuje schopnost hemoglobinu (Hb) vázat kyslík – křivka se posune směrem doprava.
K těmto změnám dochází v metabolicky aktivní tkáni, když je zapotřebí kyslík. Tvorba 2,3-DPG je ovlivněna acidobazickou rovnováhou. Kyselina mléčná snižuje afinitu ke kyslíku, když krev přichází do plic, pH stoupá a pCO2 stoupá, teplota je nižší, takže dochází k lepší saturaci Hb kyslíkem 6.
Materiál a metodika
Ve dvou etapách bylo rozmrazeno a rekonstituováno 20 TU kryokonzervovaných erytrocytů (EK). V první etapě byly erytrocyty rekonstituovány v roztoku AS-3. V druhé etapě byly erytrocyty rekonstituovány v roztoku SAG-M. Erytrocyty byly rozmrazeny a rekonstituovány s použitím automatického promývacího zařízení Haemonetics ACP 215, kdy je odstraněn glycerol a přidán rekonstituční roztok AS-3. Všechny rozmrazené TU byly vzorkovány v den 0, 7, 14 a 21. Po rozmrazení byly všechny TU skladovány 21 dní při teplotě 2–6 °C. Byl hodnocen objem přípravku a vybrané hematologické a biochemické parametry: Hb, Hct, Le (Sysmex XT 2000i), % hemolýzy výpočtem z hodnoty celkového Hb v supernatantu a celkového Hb v erytrocytech, volný Hb měřen spektrofotometricky (Spekol 11, Meopta), pH (pH metr FiveGo, Mettler Toledo), osmolalita (kryometrie, osmometr Fiske Model 2020, Advanced Instruments), K (potenciometrie: ISE s dilucí, cobas® 8000, Roche), P (fotometricky, UV test s molybdenanem amonným, cobas® 8000, Roche, NH3 (fotometricky s glutamátdehydrogenázou, cobas® 8000, Roche), ATP (bioluminiscence, ATP Bioluminescence Assay Kit HS II, Roche, luminometer LM-01A, 2,3-DPG (2,3-diphosphoglycerate, Roche – Sigma-Aldrich, Konelab 60i, Kone).
Stanovení ATP bioluminiscenční metodou
Kit/výrobce: ATP Bioluminescence Assay Kit HS II, Roche
Indikační oblast
Souprava může být použita pro bioluminiscenční stanovení adenosin-5'-trifosfátu (ATP) uvolněného ze suspenze životaschopných somatických buněk. Předpokládá se, že obsah ATP životaschopné buňky zůstává poměrně konstantní. Bioluminiscenční test HS II se používá pro vysoce citlivé a kvantitativní stanovení ATP a lze jej použít k detekci mikrobiální kontaminace.
Princip stanovení
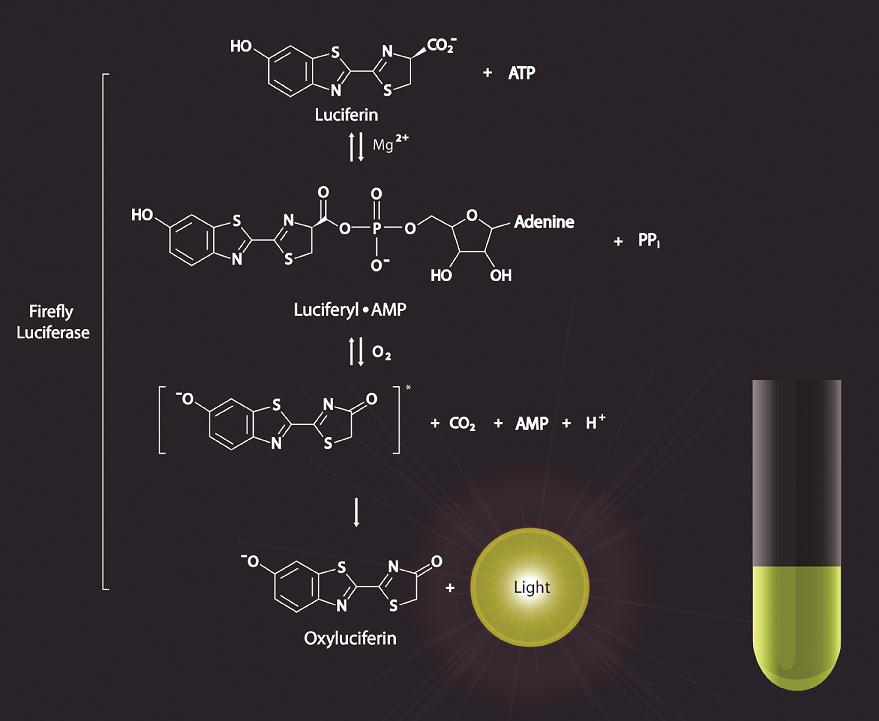
Společným znakem všech bioluminiscenčních systémů je, že světlo je produkováno jako vedlejší produkt luciferázou katalyzované reakce, ve které dochází k oxidaci substrátů nazývaných luciferázy v přítomnosti kyslíku a vždy je nutná přítomnost 2 látek: luciferázy a luciferinu, dále ATP a hořečnatých iontů. Pod pojmem luciferiny jsou zahrnuty látky, které mohou být substrátem pro enzym luciferázu a produkují světlo, např. alkoholy, flaviny, benzothiazoly, aldehydy. Luciferiny se vyskytují v buňkách nebo v mezibuněčných prostorech některých živočichů. Při oxidaci luciferázou se uvolňuje tepelné záření. Enzym luciferáza katalyzuje oxidaci specifického substrátu kyslíkem za spolupůsobení ATP a hořečnatých iontů. Oxidací se dostává molekula do excitovaného stavu, při návratu do stavu s nižší energií se uvolňuje energie ve formě světla. Pojem luciferáza je opět souhrnným názvem pro enzymy umožňující vznik bioluminiscence. ATP se vyskytuje ve všech organismech, je důležitým zdrojem energie pro živé buňky.
ATP + D-luciferin + O2 ------ > oxyluciferin + PPi + AMP + CO2 + světlo
Světlo má emisní maximum při 562 nm (viz obr. Princip bioluminiscence).
Obsah kitu
V kitu je použit stabilizovaný standard ATP.
Souprava obsahuje lyzační činidlo vyvinuté pro účinnou lýzu eukaryotických a prokaryotických buněk. Rozpuštěné reagencie jsou stabilní jeden den při 15–25 °C nebo týden při uložení při 2–8 °C.
• ATP Standard: Lahvičku rozpustit dilučním pufrem v objemu uvedeném na štítku, promíchat a inkubovat 5 minut při 2–8 °C. Poté opatrně promíchat převracením. Netřepat. Takto je připraven výchozí kalibrátor s koncentrací cca 10,4 mg/ml = 17,6 mM (cca 56,8 µl je 1 mM ATP).
• Kalibrační křivka se ředí z tohoto kalibrátoru sériově za účelem dosažení potřebného koncentračního rozmezí 1 pM až 1 mM ATP, tato kalibrace je stabilní pouze 8 hodin (degradace ATP). Do stanovení stačí použít vhodný rozsah mezi pM–nM–µM); blank = pufr.
• Lyzační činidlo pro lýzu buněk: buněčné lyzační činidlo je připraveno k použití, je třeba vyvarovat se kontaminace. Porovnání účinnosti lyzačního činidla s metodou varu – 100% (zdroj: příbalový leták).
• Lýza buněk: Ke kalibrátorům vzorkům buněk přidat stejný objem lyzačního činidla, inkubovat 5 minut při pokojové teplotě, pak centrifugovat 10 000x g 1 minutu v ultracentrifuze, supernatant přemístit do nové čisté zkumavky a použít dál pro stanovení.
Postup stanovení
Manuální pipetování (před začátkem pipetování luminometr zapnut a připraven pro vložení desky kvůli omezení časových prodlev):
• do bílé neprůhledné mikrotitrační desky pipetováno 50 µl lyzátů (kalibrátory vzestupně, pak vzorky);
• přidáno 50 µl luciferázy (rychle pipetovat) a ihned změřena destička, provedeno vyhodnocení;
• software k luminometru vytvoří kalibrační křivku – z kalibrační křivky odečte koncentrace ATP neznámých vzorků;
• odečtené koncentrace byly dále korigovány na g Hb/TU.
Rozsah měření: 10-12 až 10-5 M – viz příbalový leták
Mez detekce: 10-12 M (závisí na typu použitého luminometru)
Stanovení 2,3-DPG fotometrickou metodou
Kit/výrobce: 2,3-diphosphoglycerate (2,3-DPG), Roche
Indikační oblast
Jako meziprodukt glykolýzy hodnota 2,3-DPG charakterizuje aktuální energetický potenciál erytrocytů a in vivo schopnost uvolňovat kyslík.
Postup deproteinace vzorků
Z dodaného vzorku byla odebrána část a provedena deproteinace za pomoci 0,6M vychlazené kyseliny chloristé a 2,5M vychlazeného uhličitanu draselného:
Do čisté označené centrifugační zkumavky pipetováno:
• 5 ml 0,6M kyseliny chloristé + 1 ml vzorku;
• následně centrifugováno v chlazené centrifuze 5 000 rmp 10 minut;
• 4 ml bezbarvého supernatantu přepipetovány do čisté označené zkumavky;
• přidáno 0,5 ml 2,5M vychlazeného uhličitanu draselného;
• inkubováno 60 minut při 2–8 °C;
• čistý neutralizovaný extrakt přepipetován do označené zkumavky pro transport – k měření.
Po odběru vzorku krve se obsah 2,3-DPG uvnitř erytrocytů rychle mění. Z tohoto důvodu se proces deproteinace musí provést bezprostředně po odběru.
Vzorek byl transportován v chladu do Nemocnice Milosrdných sester sv. Karla Boromejského, kde bylo provedeno měření.
Princip metody
Kit cca pro 30 stanovení
Rozsah měření: 0,02–0,15 µmol
Kit obsahuje lyofilizované reagencie (1-Triethanolamine buffer, 2-ATP a NADH, 3-PGM, PGK, GAP-DH, TIM, GDH, 4-Phosphoglycerate mutae (PGM), 5-Glycolate-2-phosphate, tricyclohexalammonium salt), které se před začátkem stanovení rozpustí:
• 2 – redestilovanou vodou;
• 3,4 – reagencií 1 (Triethanolamine buffer);
• 5 – redestilovanou vodou.
Stabilita rozpuštěných reagencií ATP a NADP: 10 dní
Reagencie 1+2+3 mohou být smíchány v poměru pipetovacích objemů, stabilita smíchané reagencie je potom pouze 3 dny při uchovávání při 4 °C.
Postup stanovení
Stanovení bylo provedeno následujícím způsobem:
• použity skleněné kyvety (světelná dráha 1 cm);
• do blank kyvety a vzorkové kyvety pipetováno po 2,00 ml pufru (reagencie 1), 0,05 ml reagencie 2, 0,05 ml reagencie 3 (nebo 2,1 ml reagencie vzniklé smícháním 1+2+3 v poměru pipetovacích objemů);
• do vzorkové kyvety pipetována 0,1 ml extraktu vzorku a do blank kyvety 0,1 ml redestilované vody;
• obsah kyvet promíchán a inkubován 5 minut při pokojové teplotě (20–25 °C);
• po proběhnutí reakce (cca 5 minut) proměřena absorbance – A1 (vlnová délka: 340 nm, Hg 365 nm nebo Hg 334 nm);
• do kyvet následně přidány 0,02 ml reagencie 4 a 0,02 ml reagencie 5 (reagencie 4+5 lze smíchat v poměru pipetovacích objemů – stabilita 3 dny při 4 °C – a pipetovat 0,04 ml smíchaného roztoku);
• obsah kyvet promíchán; cca za 25 minut reakce ukončena;
• změřena absorbance A2 (vlnová délka: 340 nm, Hg 365 nm nebo Hg 334 nm).
Výpočty
Celkový objem vzorku V: 2,24 ml
Objem pipetovaného vzorku v: 0,1 ml
Světelná dráha d: 1 cm
Adsorpční koeficient pro NADH e: viz příbalový leták
Diluční faktor krve F: 6,582
Hematokrit HCR
Molekulová hmotnost 2,3-DPG MW: 266,037 g/mol
Ax = ((A1–A2)vzorku + (A1–A2)blank
Nesmí být překročen maximální povolený rozdíl absorbancí – viz příbalový leták, v opačném případě musí být použity objemy pipetování vzorku 0,05 ml a reagencie 1 pak 2,05 ml. Hodnota Ax pak musí být vynásobena 2.
V * MW * F * Ax
Koncentrace c = ------------------------ [g/l krve]
e * d * v * 1000 * 2
Pokud je měření založeno na objemu erytrocytů místo krve, výsledek by měl být dodatečně vynásoben 100/HCR.
Postupy stanovení a hodnocení 2,3-DPG v transfuzním přípravku
Nejprve byla stanovena konstanta, ke které byly následně vztaženy naměřené hodnoty 2,3-DPG v rozmrazených přípravcích. Touto konstantou, pro účely studie určenou jako 100 %, byl pokles hodnot koncentrace 2,3-DPG v právě rozmrazeném přípravku vůči hodnotě 2,3-DPG v čerstvé nativní krvi. Následně byl hodnocen trend dalšího poklesu 2,3-DPG v čase, tj. D7, D14 a D21 vztaženy k této konstantě.
Zpracování dat, statistika
Ke statistické analýze byl použit pro srovnávání všech sledovaných primárních i sekundárních veličin
mezi skupinami i uvnitř skupin nepárový t-test (Mann-Whitneyův U-test), s p < 0,05 při dvoustranném intervalu spolehlivosti. Pro srovnávání všech sledovaných veličin v časové posloupnosti (tj. podskupin: 0–7–14–21 dní po rekonstituci) byla použita metoda Kruskal-Wallis test (neparametrická ANOVA), porovnávající všechny hodnoty s hodnotami ve skupině v čase 0, s p < 0,05 při dvoustranném intervalu spolehlivosti.
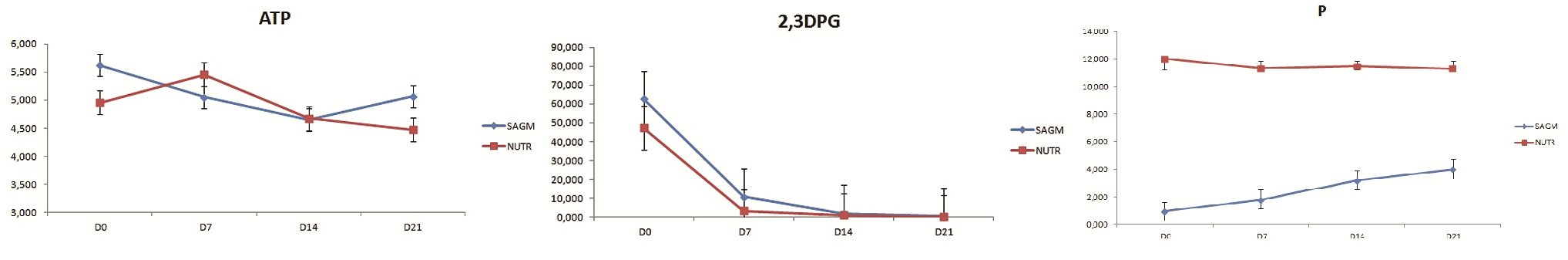
Obr. 2 (uprostřed): Hodnoty 2,3-DPG
Obr. 3 (vpravo): Hodnoty P
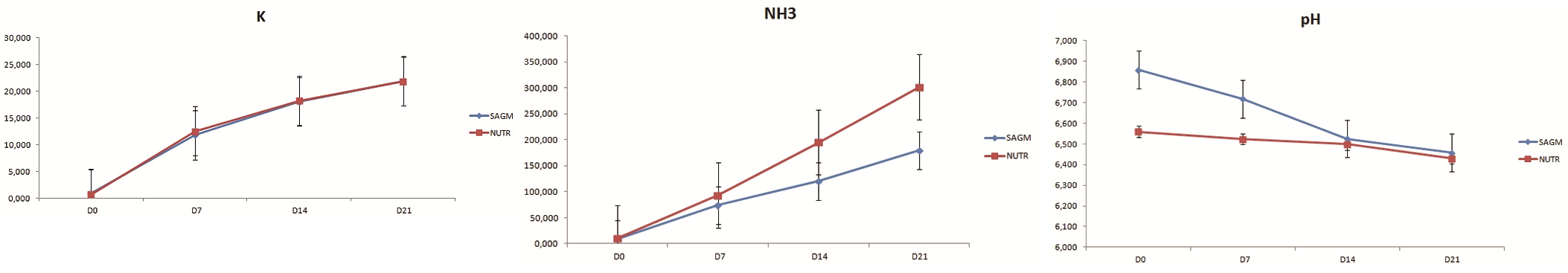
Obr. 5 (uprostřed): Hodnoty NH3
Obr. 6 (vpravo): Hodnoty pH
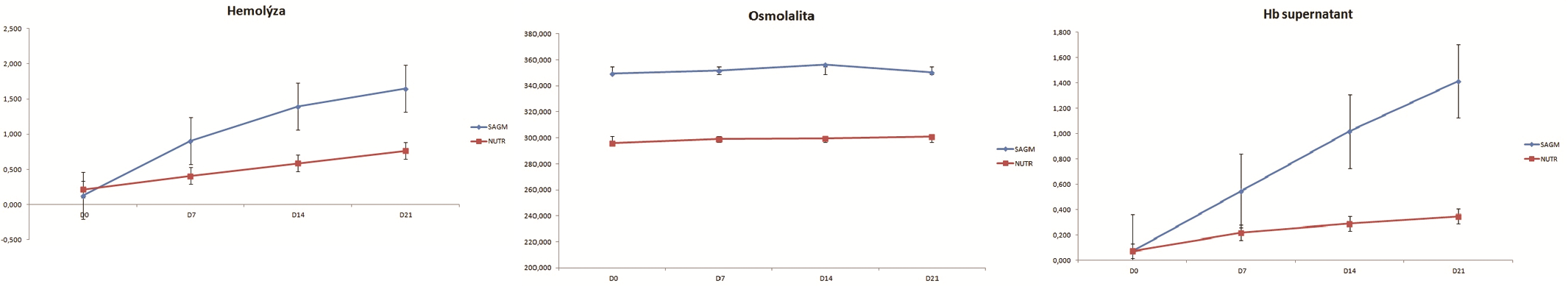
Obr. 8 (uprostřed): Hodnoty osmolality
Obr. 9 (vpravo): Hodnoty Hb v supernatantu
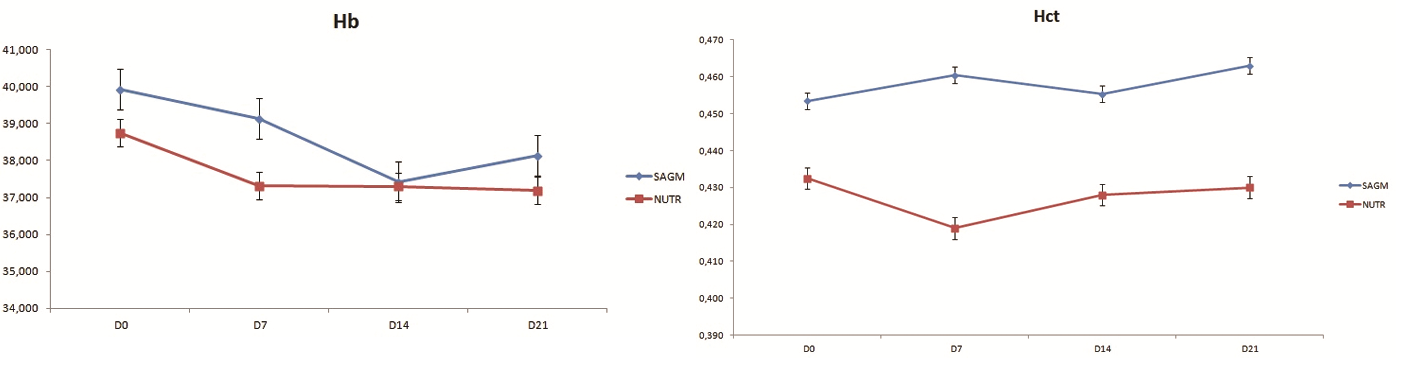
Obr. 11 (vpravo): Hodnoty hematokritu
Výsledky
Objem přípravku – Limitní hodnota pro objem byla stanovena na > 200 ml. Všechny transfuzní přípravky tuto hodnotu pro objem splnily.
ATP – Hodnota ATP byla v obou sledovaných skupinách totožná, ani změny v čase, které nebyly výrazné, nevykazovaly signifikantní rozdíly. Průměrné hodnoty ATP se pohybovaly od 4,5 µmol/g Hb do 5,6 µmol/g Hb (viz obr. 1).
2,3–DPG – U obou skupin hodnoty 2,3-DPG vykazovaly stejné změny. Po rozmrazení a rekonstituci se hodnoty pohybovaly v průměru kolem 47 µmol/g Hb (AS-3 Nutricel) a 63 µmol/g Hb (SAG-M). Parametr 2,3-DPG statisticky významně klesá během prvních 7 dní a následně je téměř konstantní. Tento trend je stejný pro obě skupiny, tj. bez signifikantního ohledu na použitý rekonstituční roztok. S největší pravděpodobnostní se 2,3-DPG uvolněný po rekonstituci erytrocytů reverzibilně váže na hemoglobin (viz obr. 2).
Fosfor – Hodnoty fosforu u skupiny s AS-3 se v průběhu času nemění, pohybovaly se kolem 11,5 mmol/l. Ve skupině se SAG-M se významně zvyšují v závislosti na čase. Po rekonstituci byly velmi nízké (0,9 mmol/l) a postupem času tyto hodnoty stoupaly až na 4 mmol/l. Rozdílné výchozí hodnoty (6x vyšší u AS-3) jsou dány obsahem kyseliny fosforečné v roztoku AS-3 (viz obr. 3).
Draslík – Hodnoty extracelulárního draslíku byly u obou skupin totožné a průběžně stoupají v závislosti na době skladování. Po rekonstituci se hodnoty pohybovaly kolem 0,7 mmol/l a postupně stoupaly až k 22 mmol/l. Významnější vzestup hodnot je patrný prvních 7 dní v souvislosti s ustalováním rovnováhy během skladování (viz obr. 4).
Amoniak – Po rozmrazení byly průměrné hodnoty amoniaku kolem 10 mmol/l (v obou skupinách). V dalších dnech skladování hodnoty amoniaku průběžně významně stoupaly až na hodnoty kolem 301 mmol/l (AS-3) a 180 mmol/l (SAG-M). Vzestup amoniaku souvisí s největší pravděpodobností s odbouráváním hemoglobinu z původně nevitálních erytrocytů vzniklých po rekonstituci (viz obr. 5).
pH – Hodnoty pH u erytrocytů rekonstituovaných v AS-3 v průběhu skladování klesaly jen nepatrně, lišily se ale nižší vstupní hodnotou 6,56 na počátku skladování, ve srovnání s hodnotou 6,868 u erytrocytů v SAG-M, kde následoval znatelnější pokles v průběhu prvních 2 týdnů až na konečných 6,4 (viz obr. 6).
Hemolýza – Úroveň hemolýzy by měla být < 1 %. U erytrocytů rekonstituovaných v AS-3 byla úroveň hemolýzy v den 0 0,215 % a postupně stoupala až na průměrnou hodnotu 0,764 % v 21. den. U erytrocytů rekonstituovaných v SAG-M byla průměrná úroveň hemolýzy v den 0 0,129 % a mnohem rychleji stoupala až na průměrnou hodnotu 1,650 % (viz obr. 7).
Osmolalita – Limit pro hodnotu osmolality je < 340 mOsm/l. Hodnoty osmolality v průběhu skladování jen velmi mírně (statisticky zcela nevýznamně) stoupaly, ale signifikantně se lišily mezi první a druhou skupinou erytrocytů. V první skupině (AS-3) se průměrné hodnoty osmolality pohybovaly kolem 296 mOsm/l v den 0
a lehce vystoupaly až na hodnotu 301 mOsm/l v den 21. Ve druhé skupině (SAG-M) byla maximální hodnota pro osmolalitu překročena již v den 0 (349 mOsm/l) a z těchto erytrocytů se tedy patrně uvolní více zbytkového glycerolu, než je schopen standardní promývací protokol odstranit (viz obr. 8).
Hb v supernatantu – Maximální hodnota pro hemoglobin v supernatantu je 0,5 g/TU po rekonstituci. U obou skupin byla průměrná hodnota Hb po rekonstituci 0,07 g/TU. U žádného transfuzního přípravku nebyla hodnota 0,5 g/TU překročena (viz obr. 9).
Obsah hemoglobinu v přípravku – Minimální hodnota pro obsah hemoglobinu v erytrocytech po rekonstituci je
30 g/TU. U všech transfuzních přípravků byla tato hodnota splněna. U erytrocytů s AS-3 byla průměrná hodnota 37 g/TU a u druhé skupiny 39 g/TU (SAFG-M). Během skladování hodnoty hemoglobinu klesaly u obou skupin v období prvního týdne, následně se již statisticky významně neměnily (viz obr. 10).
Hematokrit – Minimální hodnota pro hematokrit je >= 0,40. Během skladování se hodnoty hematokritu neměnily. Byl mírný rozdíl mezi skupinami. V AS-3 byla průměrná hodnota hematokritu 0,43. U druhé skupiny byla průměrná hodnota lehce vyšší, a to 0,46 (viz obr. 11).
Leukocyty – Limit pro hodnotu leukocytů je < 0,1 x 109/TU. U všech jednotek erytrocytů byly hodnoty leukocytů 0 x 109/TU.
Závěr
Z naměřených dat vyplývá, že erytrocytární koncentráty rekonstituované v obou roztocích mají nejlepší vitalitu a energetický potenciál v prvních dnech po rekonstituci. Z naměřených hodnot hemolýzy a hemoglobinu uvolněného do supernatantu, ale i z některých dalších parametrů je zřejmé, že erytrocyty rekonstituované v AS-3 vykazují lepší parametry kvality a vitalitu v průběhu skladování než erytrocyty resuspendované v SAG-M. Ery-trocyty v SAG-M dále nesplňují požadovanou úroveň minimální osmolality a zřejmě vyžadují jeden nebo dva promývací cykly navíc.
Naměřená data a zjištěné změny jednotlivých parametrů v čase odpovídají zjištěným hodnotám z validačních a výzkumných prací v letech 2003–2005 [2,3,4,5] a jednoznačně potvrzují shodnou kvalitu kryokonzervovaných erytrocytů skladovaných více než 10 let s erytrocyty skladovanými kratší dobu.
Použité a popsané kity a metody stanovení ATP a 2,3-DPG jsou v současné době jediné dostupné na trhu. Pro měření 2,3-DPG je nutné mít k dispozici fotometrický analyzátor se zcela otevřeným kanálem, pro stanovení ATP jakýkoli typ luminometru s měřením ve zkumavkách nebo mikrotitračních destičkách. Obě metody jsou v současné době zavedeny – podle dostupných informací – pouze v Nemocnici Milosrdných sester sv. Karla Boromejského (2,3-DPG), resp. v ÚVN Praha (preanalytická příprava pro 2,3-DPG a stanovení ATP), a lze je po dohodě s autory tohoto sdělení využít k dalšímu experimentálnímu měření i ke klinické diagnostice.