Stanovení beta amyloidu (1-42), tau proteinu celkového a tau proteinu fosforylovaného je využíváno při diagnostice Alzheimerovy choroby a jiných neurodegenerativních onemocnění. Kromě automatizovaných metod1 je laboratorně prováděna především ELISA2 a multiplexové techniky3.
Úvod
V srpnu roku 2021 byly na český trh uvedeny reagencie 2. generace pro automatizované metody Roche. Výhodou analýzy tau proteinu celkového (tTau), tau proteinu fosforylovaného (pTau) a beta amyloidu (1-42) (β-amyloid) reagenciemi 2. generace je možnost provedení na všech široce dostupných imunochemických modulech cobas e, zajišťující snadné zavedení do běžného laboratorního provozu. Ve srovnání s reagenciemi předchozí generace došlo k největší změně u stanovení β-amyloidu. Metoda byla restandardizována na IFCC CRM, byl zvýšen rozsah měření (z 200–1 700 na 150–2 500 ng/l). Cut-off hodnota se u β-amyloidu změnila z 1 000 na 1 030 ng/l. Dále byl zjednodušen preanalytický protokol. Odběr i analýzy se provádějí ve zkumavkách pro CSF kat. č. 63.614.625 (Sarstedt) a je možné standardně pracovat s čerstvým vzorkem. Výsledky jsou konzistentní s PET.4-6
Vzhledem k tomu, že na našem pracovišti byly do 8/2021 používány reagencie 1. generace a měli jsme zájem využít výhod nových setů, provedli jsme srovnání obou metod a výsledky statisticky vyhodnotili.
Materiál a metoda
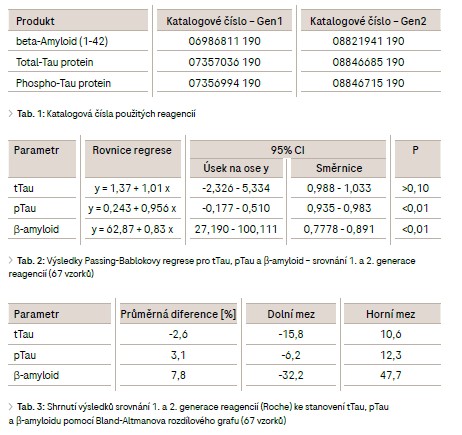
Stanovení tTau a pTau 1. generace bylo prováděno na přístroji cobas e 411 a stanovení β-amyloidu na přístroji cobas® 6000, modul e 601 (v Lab Med spol. s r.o., Brno). Metody tTau, pTau i β-amyloid 2. generace byly měřeny na přístroji cobas® 8000, modul e 801. Projekt byl schválen Etickou komisí FN Brno (č. j. 01-090119/EK) v rámci Start-up grantu. Katalogová čísla jednotlivých souprav jsou uvedena v tab. 1. Principem testů je elektrochemiluminiscenční nekompetitivní analýza. Srovnání bylo provedeno na souboru 67 vzorků a zhodnoceno za použití Passing-Bablokovy regresní analýzy a Bland-Altmanova rozdílového grafu (sw MedCalc, verze 12.5.0). Výsledky Při srovnání 1. a 2. generace reagencií ke stanovení tTau, pTau a β-amyloidu na 67 vzorcích bylo dosaženo výsledků uvedených v tab. 2 a obr. 1. U stejného souboru vzorků byl dále ke srovnání použit Bland-Altmanův rozdílový graf (tab. 3). Grafické znázornění zachycuje obrázek 2.
Diskuse
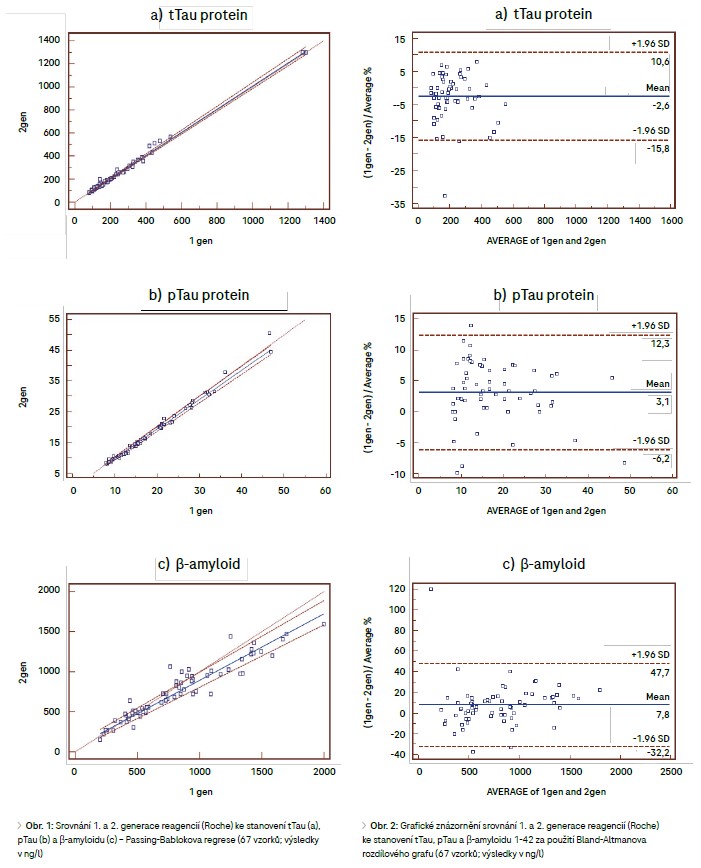
Z vyhodnocení srovnání biomarkerů neurodegenerativních onemocnění Passing-Bablokovou regresí vyplynulo, že není statisticky významný rozdíl u stanovení tTau analyzovaného 1. či 2. generací reagencií, zatímco u stanovení pTau a β-amyloidu byl na hladině P = 0,01 statisticky významný rozdíl mezi generacemi zaznamenán. Tomu odpovídají výše uvedené výsledky: 95% interval spolehlivosti (CI) úseku na ose y pro β-amyloid nezahrnuje 0 a 95% interval spolehlivosti směrnice přímky pro β-amyloid a pTau nezahrnuje 1. Z Bland-Altmanova rozdílového grafu (obr. 2) je patrné, že mezi srovnávanými soubory je malý systematický posun u parametrů tTau a pTau – průměrná diference l2,6l % a 3,1 %. Významnější posun je u β-amyloidu – průměrná diference 7,8 %. Reagencie 2. generace poskytovaly výsledky vyšší u tTau, zatímco průměrně nižší hodnoty byly u pTau a β-amyloidu, kde se projevil jak vliv nových reagencií, tak i restandardizace. Při hodnocení velikosti maximálních odchylek zjištěných pomocí Bland-Altmanova rozdílového grafu se většinou využívá srovnání s biologickou intraindividuální variabilitou uvedenou v databázi dle Westgarda7 nebo v databázi EFLM (European Federation of Clinical Chemistry and Laboratory Medicine). Námi sledované biomarkery, nové v oblasti IVD, však v těchto databázích dosud nejsou zařazeny. Vypočítanou průměrnou diferenci lze pro imunoanalytické metody hodnotit jako obvyklou a z klinického pohledu vyhovující. Reagencie 2. generace jsou stejně jako předchozí generace stabilní, interní kontrola kvality vychází dlouhodobě v požadovaném rozmezí, bez nutnosti časté rekalibrace. Nevýhodou zůstává, že stanovení tTau, pTau a β-amyloidu danou metodikou je nutno provádět pouze z likvoru a vyžaduje tedy invazivní odběr s využitím lumbální punkce.
Závěrem lze konstatovat, že výsledky získané reagenciemi pro stanovení beta amyloidu (1-42), tau proteinu celkového a tau proteinu fosforylovaného obou generací jsou z klinického hlediska dobře porovnatelné. Pokud laboratoř původně využívala 1. generaci, může plynule navázat měřením vzorků reagenciemi 2. generace a využít tak její výhody.

Reagenční souprava Elecsys® Phospho-Tau (181P) CSF je diagnostický zdravotnický prostředek in vitro. Test slouží ke kvantitativnímu měření fosforylovaného tau proteinu v lidském CSF. Spolu se stanovením Elecsys β‑Amyloid (1–42) CSF II se používá na zjištění poměru jejich koncentrací u dospělých jedinců s kognitivní poruchou, u nichž se zvažuje diagnóza Alzheimerovy choroby a jiné příčiny kognitivní poruchy. Rozsah měření: 8–120 pg/ml. Reagenční souprava Elecsys® β‑Amyloid (1–42) CSF II je diagnostický zdravotnický prostředek in vitro. Test je určen pro imunochemické kvantitativní stanovení koncentrace β‑amyloidového (1–42) proteinu v lidském mozkomíšním moku (CSF). Rozsah měření: 150–2500 pg/ml. Reagenční souprava Elecsys® Total‑Tau CSF je diagnostický zdravotnický prostředek in vitro. Test je určen pro kvantitativní měření celkového tau proteinu v lidském CSF. Rozsah měření: 80–1300 pg/ml. Elektrochemiluminiscenční imunostanovení „ECLIA“ se používá na analyzátorech cobas e. Sendvičový princip. Určeno k použití odborníky ve zdravotnictví.