Úvod

Parathyroidní hormon (PTH, parathormon) je základní regulační hormon kalcium-fosfátového metabolismu. Gen pro syntézu parathormonu je umístěn na krátkém raménku chromozómu 11. PTH je syntetizován na ribozomech buněk příštítných tělísek jako pre-pro-PTH o délce 115 aminokyselin (AK). V endoplazmatickém retikulu a v Golgiho aparátu je zkrácen na pro-PTH o délce 90 AK a následně o dalších 6 AK na molekulu intaktního PTH. Intaktní molekula PTH je tedy tvořena řetězcem 84 AK. Degradace intaktního PTH začíná již v příštítných tělískách a pokračuje především v játrech a ledvinách. Vzniká velké množství N- a C-fragmentů o různých délkách řetězce1,2. V krvi zdravých osob s normální kalcémií je přítomno přibližně 18 % intaktního PTH (1-84), 75 % tvoří krátké C-terminální fragmenty (34-, 37-, 38-, 45-84), 5 % tvoří fragmenty PTH bez několika prvních aminokyselin (5-, 7-, 8-, 10-, 15-84, s převahou fragmentu 7-84), tzv. PTH non-(1-84) fragmenty3. Až 2 % může tvořit posttranslačně modifikovaný amino-PTH, ve kterém je fosforylován serin v pozici 17.4
Klinický význam stanovení PTH má úzkou souvislost s diagnostikou změn minerálového a kostního metabolismu, a to především u pacientů s onemocněním ledvin.5,6 U těchto pacientů, zejména u pacientů s chronickým renálním onemocněním (CKD) na dialýze, se výrazně mění kalcémie spolu s koncentrací a zastoupením jednotlivých fragmentů PTH v krvi2 s kumulací C- a non-(1-84) fragmentů, které tvoří až 95 % celkového PTH v krvi.7 Z výše uvedených důvodů patří stanovení PTH k metodicky nejnáročnějším imunoanalytickým postupům. Imunoanalytické metody stanovení PTH z hlediska vývoje dělíme na metody tří generací. Metody první generace (1963–1980) využívaly radioimunoanalýzy s použitím polyklonálních protilátek, které detekovaly epitopy ve střední oblasti C-fragmentu PTH (nejčastěji oblast 49-84 AK).8 Metody první generace tedy nadhodnocovaly koncentraci intaktního PTH (1-84) prakticky o všechny C- a non-(1-84) fragmenty. Imunoanalytické metody 2. generace zavedené v roce 19879 využívají dvě monoklonální protilátky, z nichž jedna je namířena proti epitopu situovanému mezi 26-32 AK a druhá proti epitopu blíže k C-terminálnímu konci aminokyselinového řetězce PTH (39-84). Tím mělo být zaručeno, že bude detekována pouze nerozštěpená intaktní molekula PTH. Tyto metody dostaly z dnešního pohledu nevhodný název, a to metody pro stanovení intaktního PTH. Teprve metody 3. generace (po roce 1999) reagovaly na identifikaci tzv. non-(1-84) fragmentů. Jedna z monoklonálních protilátek je zacílena na detekci epitopu tvořeného prvními pěti AK N-terminální části PTH a druhá monoklonální protilátka proti části řetězce PTH v oblasti 54-59 AK. Tyto metody detekují opravdu jen intaktní molekulu PTH (1-84).10,11
V současné době existuje široká nabídka metod pro stanovení PTH, a to jak metod 2. generace, tak i metod 3. generace. Výsledky analýz jsou tudíž obtížně klinicky srovnatelné. Stabilita, preanalytické podmínky skladování a druh vzorků vhodný pro stanovení PTH jsou velmi obšírně v literatuře probírány s nejednoznačnými závěry.12,13,14 Není ani překvapivé, že pokud je stabilita vzorků posuzována metodami různé generace, které detekují různé fragmenty PTH, jsou získány diskrepantní výsledky. Ucelené informace o preanalytických podmínkách stanovení PTH shrnuje recentní review Hanona15 připravené ve prospěch „IFCC Scientific Division Working Group on PTH“. V této práci autoři shrnuli 83 publikací zabývajících se kvantitativním stanovením PTH a pokusili se vytvořit doporučení pro správné stanovení koncentrace tohoto hormonu. Hlavním výstupem uvedené práce je doporučení, že preferovaným analyzovaným materiálem pro stanovení PTH má být EDTA plazma skladovaná při 4 °C maximálně 72 hodin. Odběr má být proveden ideálně mezi 10.–16. hodinou. Tato metaanalýza má ale svá omezení, protože většina studií využívala především metody 2. generace a sdružovala stanovení koncentrací PTH v různých materiálech (změny v plné krvi, séru, plazmě, ve zmrazených vzorcích atd.). Na limitace těchto doporučení upozorňuje také E. Cavalier, který je paradoxně spolutvůrcem uvedeného doporučení.16 V literatuře tedy nenajdeme jednoznačný závěr, jaký primární materiál pro stanovení koncentrace PTH použít, ani jaká je stabilita koncentrace PTH v primárním vzorku před centrifugací. Rozhodli jsme se proto srovnat stabilitu PTH v závislosti na použitém druhu primárního materiálu, a na podmínkách uchovávání primárních vzorků před přípravou vlastního analytického vzorku (teplotě a době uchovávání primárních vzorků). Vliv těchto faktorů jsme se snažili posoudit i s ohledem na použitou metodu stanovení, resp. její generaci.
Cíl
Srovnání stability PTH v různých typech primárních vzorků v závislosti na teplotě a době jejich uchovávání před přípravou vzorků analytických, s dopadem na výsledek měření PTH při použití metody 2. a 3. generace.
Metodika
Pro analýzu byly použity vzorky 20 pacientů s dg. CKD (dg. 18.9) z dialyzačního centra Interní kliniky FN Ostrava. Každému z 20 pacientů byla odebrána krev do tří typů 7,5ml zkumavek S-Monovette® (Sarstedt AG & Co., Germany) – první typ obsahoval 14,4 mg K3EDTA, druhý obsahoval 144 I.U. heparinátu lithného a třetí obsahoval aktivátor srážení. Okamžitě po odběru byla krev promíchána a z každé zkumavky bylo připraveno sedm alikvotů. Jeden alikvot z každého materiálu byl okamžitě centrifugován (2000 x g, 4 °C, 10 minut) a v takto připraveném analytickém vzorku byla stanovena koncentrace PTH. Získané výsledky byly označeny jako čas T0. Tři alikvoty každého materiálu byly dále inkubovány při pokojové teplotě (RT) a zbylé tři alikvoty při teplotě 4 °C (LT), přičemž během inkubace byly alikvoty nepřetržitě míchány. Pro sledování vlivu délky inkubace byly zvoleny tři časové intervaly: 2 hodiny (T2), 6 hodin (T6) a 24 hodin (T24). Po uplynutí této doby byly alikvoty centrifugovány a v získaném materiálu (plazmě, resp. séru) byla stanovena koncentrace PTH. Vlastní stanovení koncentrace PTH bylo simultánně provedeno dvěma metodami různé generace.
Metodou 3. generace bylo tzv. biointaktní stanovení Elecsys® PTH (1-84) realizované na přístroji cobas e 411 (Roche Diagnostics, GmbH, Germany). Jde o metodu specificky reagující pouze s „biointaktní“ molekulou PTH (1-84) a nikoliv s PTH non-(1-84) fragmenty. Principem stanovení biointaktního PTH (1-84) je automatizovaná jednokroková elektrochemiluminiscenční metoda, ve které je biotinylovaná monoklonální protilátka směrována proti epitopům N-terminálního konce PTH (1-5) a signální monoklonální protilátka proti epitopům C-terminální oblasti PTH (54-59). Metodou 2. generace bylo stanovení intaktního PTH (Intact PTH) na přístroji Immulite 2000 XPi (Siemens Medical Solutions Diagnostics, NY, USA). Jde o enzymoimunoanalytické stanovení s chemiluminiscenční detekcí, kdy je monoklonální protilátka směrována proti epitopům C-terminální oblasti PTH (44-84) a signální polyklonální protilátka proti epitopům N-terminálního konce PTH (1-34). Tato metoda dle příbalové dokumentace vykazuje 44,8% zkříženou reaktivitu s fragmentem PTH (7-84). Statistické hodnocení dat bylo provedeno v prostředí jazyka R. Pro všechny statistické testy byla zvolena hladina významnosti alfa = 5 %. Normalita distribuce dat byla ověřena Shapiro-Wilkovým testem. Vliv času a teploty na koncentraci PTH byl vyhodnocen dvoufaktorovou analýzou rozptylu (ANOVA).
Výsledky
V tabulce 1 jsou prezentovány relativní rozdíly mezi koncentracemi PTH zjištěnými v čase T0 pomocí metody měření intaktního PTH (metoda 2. generace) na přístroji Immulite 2000 XPi a metody 3. generace pro stanovení biointaktního PTH na přístroji cobas e 411. Výsledky získané stanovením biointaktního PTH jsou signifikantně nižší než výsledky měření intaktního PTH. V případě odběrové zkumavky s přídavkem K3EDTA je koncentrace PTH měřená metodou intaktního PTH dokonce vyšší o 107 %. Na obrázku 1 je zachycena závislost procentuální změny průměrné koncentrace PTH (s vyznačeným 95% intervalem spolehlivosti) vůči jeho koncentraci v čase T0. Tato změna je prezentována pro každý ze tří typů sledovaných primárních materiálů a pro tři doby jejich uskladnění při pokojové teplotě (24 ± 2 °C): konkrétně po 2, 6 a 24 hodinách (T2, T6, T24). Rovněž je zde znázorněn přípustný průměrný bias měření (B% = ±10,7 %), odvozený z publikovaných biologických variabilit koncentrace PTH pro sérum a plazmu.17
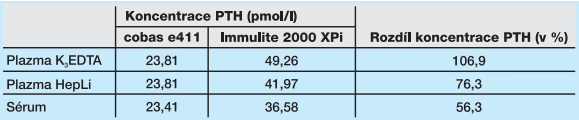
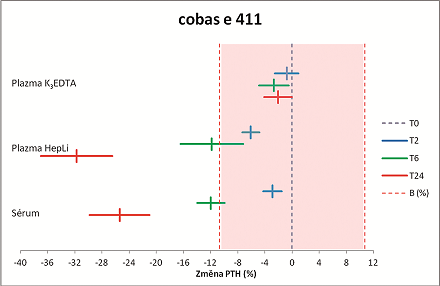
Výsledky ukazují, že koncentrace PTH je závislá nejen na metodě měření, ale i na dalších proměnných, a to jak na typu analyzovaného materiálu, tak i na podmínkách jeho uchovávání před vlastním měřením. V případě stanovení koncentrace bio-intaktního PTH na přístroji cobas e 411 nebyla během skladování primárního vzorku při pokojové teplotě pozorována signifikantní změna koncentrace PTH u vzorků krve odebraných do zkumavek s přídavkem K3EDTA. Při použití zkumavek s přídavkem heparinátu lithného nebo zkumavek s aktivátorem srážení dochází v primárním vzorku k signifikantnímu poklesu koncentrace PTH již po dvou hodinách skladování, po 6 hodinách činí tento pokles cca 12 % a v čase T24 je větší než 25 %, přičemž u heparinátu lithného je pokles koncentrace PTH podstatně vyšší. Pokud jsou primární vzorky ihned po odběru uchovávány při 4 °C, nedochází k signifikantním změnám koncentrace PTH ani u jednoho typu materiálu, dokonce ani po 24 hodinách.
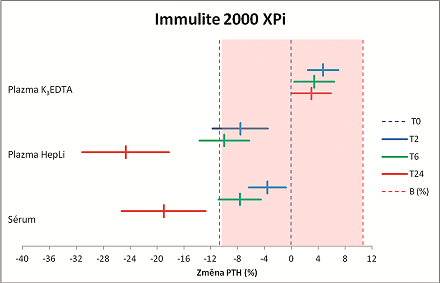
Při stanovení koncentrace intaktního PTH na přístroji Immulite 2000 XPi dochází během skladování při pokojové teplotě v primárním vzorku s přídavkem K3EDTA paradoxně k mírnému nárůstu (cca 3–5 %) koncentrace PTH, s délkou skladování se tento nárůst lehce snižuje. U vzorků srážlivé krve nebo odběru do zkumavek s přídavkem heparinátu lithného dochází k signifikantnímu poklesu koncentrace PTH již po dvou hodinách. S prodlužující se dobou skladování se tento pokles dále zvětšuje, přičemž i v tomto případě je pokles výraznější u zkumavek s heparinátem lithným. Pokud jsou primární vzorky ihned po odběru uchovávány při 4 °C, dochází ke změně koncentrace PTH větší než přípustná odchylka 10,7 % teprve po 6 hodinách skladování, a to jen u vzorků odebraných do zkumavek s akcelerátorem srážení.
Diskuse
Ve shodě s publikovanými údaji18,19,20 byly i v našem případě nalezeny statisticky významně nižší koncentrace PTH měřené metodou 3. generace ve srovnání s metodou 2. generace. Zajímavé je, že v případě měření biointaktního PTH jsou koncentrace PTH v čase T0 téměř shodné, a tedy nezávislé na odebraném materiálu. Oproti tomu v případě intaktního PTH měřeného na přístroji Immulite 2000 XPi jsou koncentrace PTH již v čase T0 významně závislé na typu primárního materiálu. Vysvětlení by mohlo mít souvislost s přímým ovlivněním metody přidaným aditivem nebo s velmi rychlou počáteční degradací PTH, včetně fragmentu PTH (7-84) v případě sérového vzorku.

Z našich výsledků i z velkého množství literárních zdrojů je zřejmé, že problematika preanalytické fáze při stanovení koncentrace PTH je velmi složitá a je nutné jí věnovat náležitou pozornost. Výrobci IVD prostředků pro stanovení koncentrace PTH v příbalové dokumentaci odkazují pouze na stabilitu PTH ve vzorku připraveném k analýze, tedy v již separovaném materiálu. V případě firmy Roche je preferovaným materiálem pro stanovení EDTA plazma, která může být skladována až 24 hodin při 15–25 °C. Výrobce ale připouští i stanovení v séru, které je však třeba odseparovat co nejdříve po provedení odběru. Firma Siemens doporučuje v příbalovém letáku rovněž EDTA plazmu, kterou je možné v lednici skladovat maximálně 8 hodin. Ani jeden z těchto výrobců ale nic neříká o stabilitě PTH v primárním materiálu, čímž je myšlena plná nebo srážlivá krev, přičemž z preanalytického hlediska je tento aspekt neméně důležitý. O souhrn těchto informací se pokouší metaanalýza Hanona,15 která srovnává 83 publikací zabývajících se kvantitativním stanovením PTH. Tato práce přímo doporučuje preferovat stanovení koncentrace PTH v EDTA plazmě, která má být skladována při 4 °C maximálně 72 hodin. Nevýhodou této metaanalýzy, což zmiňuje s odstupem času i její spolutvůrce,16 je to, že byly analyzovány především práce s metodami 2. generace a také že v jednotlivých publikacích jsou použity různé přístupy zpracování vzorku před vlastním stanovením koncentrace PTH (skladování plné krve nebo jen séra či plazmy). Navíc je stanovení PTH prováděno za různých podmínek (ihned po centrifugaci, ve zmrazených alikvotech atd.).
Bez ohledu na uvedená omezení jsou naše výsledky spíše v souladu s tímto doporučením.15 V případě obou sledovaných metod stanovení je zřejmé, že nejvhodnějším primárním materiálem z hlediska stability koncentrace PTH je krev odebraná do zkumavky s příměsí K3EDTA. Potvrdili jsme, že i při pokojové teplotě je v tomto primárním materiálu koncentrace PTH stabilní, a to dokonce i poté, kdy je separace plazmy provedena až po 24 hodinách. Oproti tomu je stabilita koncentrace PTH v krvi odebrané do zkumavek s aktivátorem srážení nebo s příměsí heparinátu lithného omezena pouze na dvě hodiny. Toto zjištění je také v souladu s prací E. Cavaliera14, který testoval stabilitu koncentrace PTH měřené metodou Liaison (1-84) PTH (Diasorin, metoda 3. generace). I on pozoroval stabilní koncentraci ve vzorcích krve odebíraných do zkumavek s K2EDTA při pokojové teplotě i po 24 hodinách. Separaci séra ze srážlivé krve skladované při pokojové teplotě doporučuje provést do osmi hodin.
Možné vysvětlení výrazného poklesu koncentrace PTH ve srážlivé krvi a v séru částečně přináší práce autorů La'ulu a kol. z roku 2014, kteří testovali vliv trombinu na degradaci PTH.21 Autoři zjistili, že trombin pravděpodobně způsobuje degradaci PTH, ale zřejmě není jediným ovlivňujícím faktorem. Pokles koncentrace PTH byl pozorován i v plazmě s heparinátem lithným. Jiná situace nastává v případě skladování primárních vzorků krve při 4 °C. Metoda 3. generace firmy Roche poskytuje shodné výsledky i po 24 hodinách pro všechny materiály. Cavalier a kol.14 ale pozorovali v případě jednoho pacienta nečekaný pokles koncentrace PTH již po 4 hodinách v případě skladování primárního vzorku krve s přídavkem K2EDTA při teplotě 4 °C. Při použití metody 2. generace firmy Siemens lze srážlivou krev a krev s heparinátem lithným použít pouze do 6 hodin po odběru materiálu, poté je již pokles koncentrace PTH neakceptovatelný vzhledem k přípustné odchylce. Přes vývoj metod 3. generace, které poskytují výsledky měření skutečně pouze intaktního PTH, a přes další výzkum v oblasti preanalytické fáze je ale situace se správným měřením koncentrace biologicky aktivního PTH mnohem komplikovanější. U pacientů s CKD podstupujících dialýzu bylo zjištěno, že vlivem oxidativního stresu dochází v molekule PTH k oxidaci methioninu v pozicích 8 a 1822, což vede ke ztrátě aktivity tohoto hormonu.23 Autoři těchto prací dokonce naznačují, že bude nutné vyvinout metody 4. generace, které by měřily pouze neoxidovaný intaktní PTH (1-84), protože „skutečná“ koncentrace aktivního PTH je cca o 30–50 % nižší.22
Závěr
Stanovení PTH je velmi složité vzhledem k množství různých fragmentů přítomných v krvi, a to nejen za fyziologických, ale především patologických podmínek. I přes neustálé zlepšování diagnostiky je vždy nutné brát ohled na preanalytické podmínky a stabilitu primárního vzorku, a koncentrace PTH vždy posuzovat jen ve vztahu k primárnímu materiálu a příslušné metodě stanovení. Naše výsledky potvrzují, že nejvýhodnějším primárním materiálem pro stanovení koncentrace PTH je krev odebraná do zkumavek s přídavkem K3EDTA. Zvláště při předpokládaném či nutném delším transportu materiálu do laboratoře se jeví zkumavka s přídavkem K3EDTA jako nejoptimálnější, neboť se v ní koncentrace PTH významně nemění dokonce ani po 24 hodinách skladování při pokojové teplotě. Stabilní koncentrace PTH jsou při volbě tohoto primárního materiálu získávány jak metodou 2. generace (Intact PTH, Immulite 2000 XPi), tak i metodou 3. generace (PTH (1-84) biointact, cobas e 411).