Cílem tohoto sdělení je uvést přehledně současné možnosti diagnostiky a monitorování zhoubných nádorů v klinickobiochemické laboratoři s důrazem na novinky posledních let.
Úvod
Úvodem je nutno říci, co vlastně můžeme hledat při pátrání po zhoubném nádoru. Jedná se o tyto možnosti:
- gen (BRCA 1, 2, APC, TP53…);
- produkt genu (většinou proteiny) – klasické solubilní nádorové markery;
- tkáňové a buněčné markery:
a. cirkulující nádorové buňky;
b. cirkulující nádorová DNA (ct-DNA).
Nádorovým markerem rozumíme substanci přítomnou v nádoru nebo produkovanou nádorem nebo hostitelem jako odpověď na přítomnost tumoru. Tuto substanci lze využít k diferenciaci nádoru od normální tkáně nebo uvažovat o přítomnosti tumoru na základě analýzy tělesných tekutin. Substanci je možné měřit kvalitativně nebo kvantitativně metodami chemickými, imunologickými nebo metodami molekulární biologie. Je však nezbytné vědět, že nezvýšená koncentrace nádorového markeru není důkazem nepřítomnosti maligního onemocnění, naopak pozitivní výsledek nemusí nutně znamenat přítomnost zhoubného nádoru.1 Zásadním faktorem, který komplikuje využití nádorových markerů, je heterogenita nádorů.1 Nádory pocházejí z různých tkání, z různých buněčných typů v jedné tkáni, mají další histologické subtypy a díky různým mutacím v nádorových buňkách a dalším mutacím v dceřiných nádorových buňkách je výsledné buněčné složení velmi heterogenní. V závislosti na stupni diferenciace či dediferenciace jsou pak nádory agresivní, méně agresivní a neagresivní. Vzhledem k heterogenitě nádoru může být produkce nádorových markerů odlišná u stejných histologických typů (např. 2 pacienti s karcinomem tlustého střeva, každý má jiné spektrum zvýšených nádorových markerů). Každý zhoubný nádor je unikátní a je pravděpodobně charakterizován unikátními nádorovými markery. Neexistují tedy až na výjimky (PSA a tyreoglobulin) žádné nádorově specifické ani orgánově specifické markery.2
Co se týká klasických nádorových markerů, je třeba úvodem zmínit, k čemu je možno je využívat. V úvahu přicházejí tyto oblasti:
- Screening a primární diagnostika – vzhledem k poměrně nízké diagnostické senzitivitě a specificitě není většina nádorových markerů vhodná k tomuto účelu u asymptomatických vyšetřovaných. U symptomatických nemocných nebo u skupin pacientů s vysokým rizikem vývoje nádorového onemocnění lze použít některý
z nádorových markerů ke screeningu choroby.1 - Diferenciální diagnostika – při nálezu nádoru nejasného původu či metastatického postižení může spektrum několika nádorových markerů nasměrovat lékaře k definitivní diagnóze (za doplnění zobrazovacích vyšetření a biopsie s následným histologickým vyšetřením).
- Rozsah onemocnění – vysoká hodnota nádorového markeru v séru může indikovat pokročilou fázi či generalizaci nádorového onemocnění.
- Prognóza – určení prognózy onemocnění je omezeno pouze na několik markerů: Značný význam má AFP a hCG u germinativních tumorů, určitý význam má hodnota CEA u kolorektálních karcinomů, případně β2 mikroglobulin u myelomů.1
- Sledování průběhu choroby – je hlavní indikací těchto vyšetření. Součástí sledování pacientů po protinádorové léčbě je monitorování remise a časná detekce relapsu. K tomuto účelu je velmi vhodné vyšetřování odpovídajících nádorových markerů v definovaných intervalech.
- Účinek terapie – sledování účinku terapie v jejím průběhu (chemoterapie, radioterapie, chirurgická terapie, imunoterapie) pomocí nádorových markerů je významnou indikací vyšetření solubilních nádorových markerů.
Je nutno mít na paměti, že většina nádorových markerů se může zvyšovat v důsledku nenádorového onemocnění – velmi často se např. zvyšuje CA 19-9 a zejména CA 125 u pleurálních či břišních výpotků. Přehledná tabulka příčin nenádorového zvýšení viz např. v Doporučení k využití nádorových markerů v klinické praxi.1
Geny asociované s nádory
Co se týče genů asociovaných s nádory, spadá tato oblast do působnosti klinické genetiky či onkogenetiky, a je tedy mimo rámec tohoto sdělení. Pouze stručně zmiňuji základní fakta. Mezi nejčastější hereditární malignity patří:
- hereditární nádorová predispozice ke karcinomu prsu a ovaria (HBOC) – geny BRCA 1, 2;
- hereditární nepolypózní kolorektální karcinom (HNPCC) – Lynchův syndrom – geny MLH1, MSH2, MSH6;
- familiární adenomatózní polypóza (FAP) – gen APC.
Rozvoj nádorů u hereditárních malignit popisuje Knudsonova teorie dvojího zásahu: Jedním zásahem je přítomnost jedné mutované alely tumor-supresorového genu s přítomností germinální mutace ve všech buňkách organismu (autozomálně dominantní dědičnost) a druhým zásahem je získaná somatická mutace vedoucí ke ztrátě heterozygozity v somatických buňkách se ztrátou funkce obou alel příslušného tumor-supresorového genu, vedoucí k rozvoji malignity.
Klasické nádorové markery
Co se týká jejich kompletního výčtu, je dostupný přehledně v tab. č. 1 – příloze Doporučení k využití nádorových markerů v klinické praxi.1 Kombinace relevantních nádorových markerů výrazně zvyšuje diagnostickou efektivitu. Běžně dochází při relapsu choroby k vzestupu jen některého markeru z vyšetřované palety u jednoho pacienta. Po dokončení první fáze léčby by mělo být provedeno kontrolní měření nádorového markeru nezávisle na tom, zda byla vstupní hodnota v rámci nebo mimo referenční rozmezí.2 Použitá analytická metoda by měla být uvedena spolu s výsledkem měření! Tento fakt je dán nedostatečnou standardizací a tím pádem chybějící srovnatelností metod různých výrobců. Klinický dopad to má zejména při putování onkologických pacientů mezi různými pracovišti, např. regionální pracoviště vs. Komplexní onkologické centrum.2 100% vzestup nádorového markeru vztažený na bazální hodnotu daného pacienta téměř vždy znamená 100% nádorovou specificitu, a to i v rámci referenčního rozmezí.3 V posledních letech nádorových markerů tohoto typu již tolik nepřibývá, ale z těch přínosných je třeba zmínit marker HE4, jehož použití společně s CA 125 v rámci ROMA skóre přineslo pokrok v diagnostice ovariálních karcinomů.
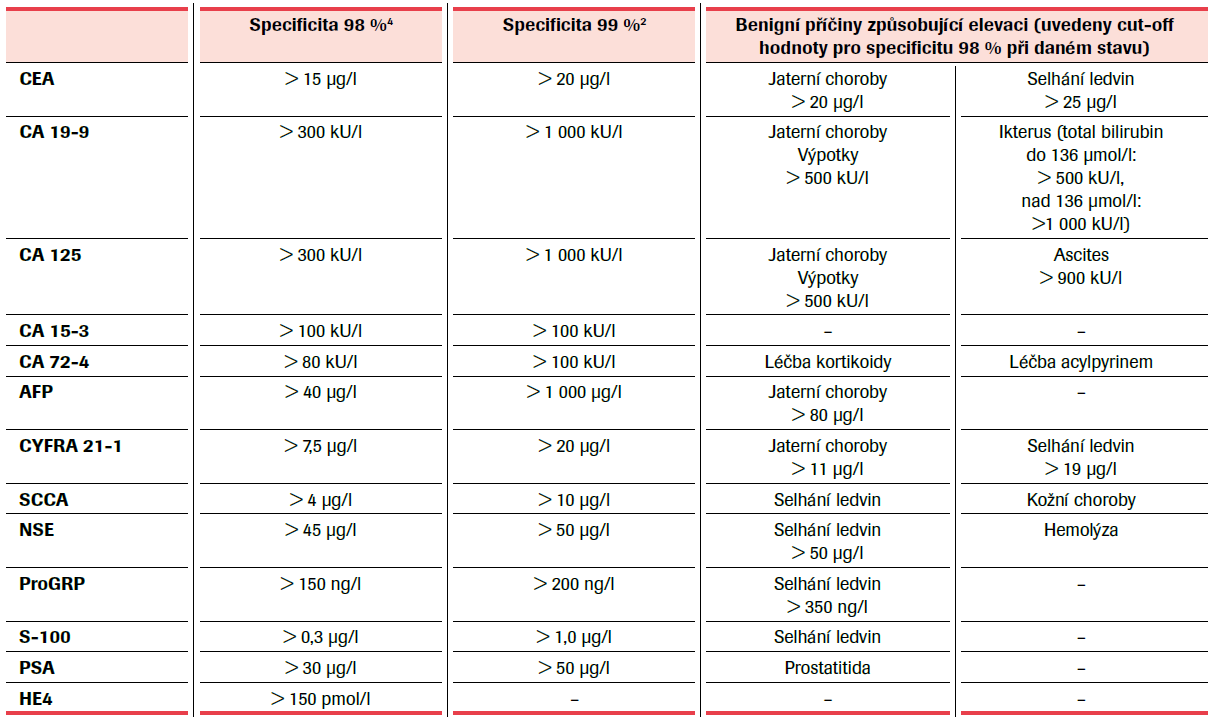
Nádorové markery u nádorů neznámé lokalizace
Až 20 % nemocných přijatých do nemocnice se zhoubným nádorem má pokročilé stadium choroby, 2–6 % nově diagnostikovaných nemocných se solidním zhoubným nádorem má dg. „nádor neznámé lokalizace“ (CUP = cancer of unknown primary site). K bližšímu určení primárního nádoru napomáhají stanovené cut-off hodnoty s vysokou nádorovou specificitou 98–99 %, které jsou uvedeny v tab. č. 1. Využitím těchto specifických cut-off hodnot lze zpřesnit určení primárního nádoru a nasměrovat diagnostiku k adekvátní biopsii. Pro zajímavost jsou v tabulce uvedeny hodnoty se specificitou 98 % i 99 % – jejich rozdílná hodnota, např. u CA 125–300 kU/l a 1 000 kU/l, vypovídá o tom, že i v intervalu 300–1 000 kU/l se mohou nacházet nenádorové příčiny zvýšení uvedeného markeru. Porovnání těchto dvou hodnot u různých markerů je nejen zajímavé, ale pro klinickou praxi velmi poučné.
Tekutá biopsie – stanovení volné cirkulující DNA
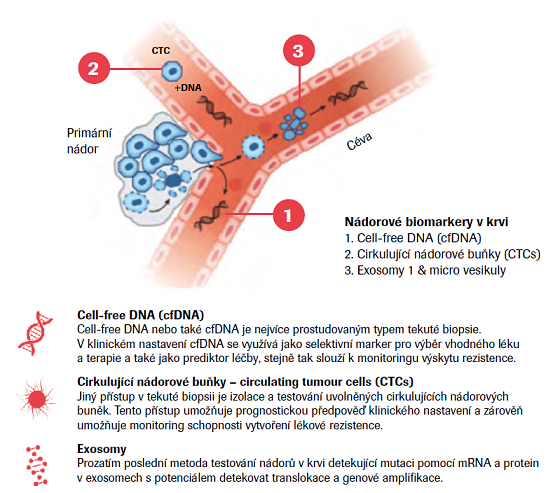
Toto téma by jistě vydalo na samostatný článek, nicméně si dovolím shrnout pouze základní charakteristiku a přínosy této metodiky.5,6 Volná cirkulující DNA, z anglického výrazu cell-free DNA (cfDNA), představuje extracelulární krátké fragmenty dvouřetězcových molekul DNA o délce 180 bp, vyskytující se v krevním oběhu a jiných tělních tekutinách člověka.7 CfDNA (v tomto konkrétním případě nádorové DNA také označována jako ctDNA) v krevní plazmě zdravých jedinců byla poprvé popsána v roce 1948.8 V roce 1977 Leon et al. popsali výskyt cfDNA v souvislosti s nádory.9 V periferní krvi zdravých jedinců se cfDNA vyskytuje ve velmi nízkých koncentracích (10–100 ng/ml). K uvolnění fragmentů molekul DNA z buněk dochází apoptózou, tedy programovanou buněčnou smrtí.10 Vyšší koncentrace cfDNA nacházíme u stavů, jako je zánět, trauma, operační zákrok, infarkt či autoimunitní onemocnění. Zvýšené hladiny cfDNA v krevním řečišti jsou výsledkem nadměrného uvolnění fragmentů molekul DNA, které byly způsobeny masivním úmrtím buněk či nedostatečným odstraněním uvolněné DNA z mrtvých buněk činností jater.6 Výrazně vyšší hladiny cfDNA, dosahující koncentrace až 1 000 ng/ml, jsou patrné především u různých druhů malignit a zejména pak u pacientů s metastázemi.5
Detekce nádorově specifické cfDNA, nazývaná také tekutá biopsie (liquid biopsy), se stává nadějným nástrojem pro minimálně invazivní monitoring pacientů s maligním onemocněním. Frakce DNA pocházející z nádorové tkáně se volně vyskytují v periferní krvi těchto pacientů (zejména v pokročilých stadiích nemoci). Nedávné studie také ukázaly, že cfDNA odvozená od nádorových buněk může být použita pro monitorování nádorové masy a odpovědi na léčbu u pacientů se solidními nádory, ale také u pacientů s hematologickými malignitami. Hladiny cfDNA v plazmě pacientů korelují s progresí nemoci, umožňují kontinuálně sledovat minimální reziduální chorobu, určit molekulární relaps onemocnění a zahájit tak včasnou léčbu.11 Před vlastní analýzou cfDNA je třeba izolovat DNA, např. firma ROCHE nabízí izolátory nukleových kyselin MagNA Pure 24 a 96, které jsou schopny izolovat cfDNA nádorového původu ze 2 nebo 4 ml plazmy. Pro detekci mutací v omezeném počtu genů se jako nejvhodnější jeví různé varianty digitální PCR – na mikročipech či mikrokapkách nejlépe v kombinaci s metodou BEAMing, která je založena na zachycení DNA na magnetické kuličky a následné analýze pomocí digitální PCR. CtDNA může být s její pomocí detekována i v případech, kdy ji DNA ze zdravých buněk přečísluje v poměru 10 000 : 1. Technologie sekvenování nové generace (next generation sequencing – NGS) jsou aplikovatelné na analýzu DNA v plazmě a umožňují podrobnější detekci mutací v rozsáhlejších oblastech genomu.12,13,14
Nádorové markery v širším smyslu
Zde zmíním pouze kvantitativní stanovení hemoglobinu ve stolici, prováděné v rámci screeningu kolorektálního karcinomu. Jedná se o principiálně jednoduché vyšetření, které však nepochybně zachraňuje životy. Jen z vlastní zkušenosti vím o mnoha lidech, u nichž toto vyšetření provedené v naší laboratoři vedlo k odhalení zhoubného nádoru v časné fázi, což zabránilo rozvoji pokročilého novotvaru a umožnilo jeho endoskopické odstranění bez zátěže velkou břišní operací. Řada z nich, kdykoli je potkám, je nesmírně vděčná, že jsme jim toto vyšetření provedli. Odpusťte prosím trochu toho sentimentu, ale pro dokreslení významu tohoto stanovení jsem to považoval za nezbytné. Jsem přesvědčen o tom, že vyšetření s takovýmto dopadem na osud pacientů by mělo být prováděno výhradně v akreditovaných laboratořích, hluboce vzdělanými pracovníky a na robustních analyzátorech – ať už jsou určeny pouze na toto vyšetření, či se jedná o aplikace na mnohakanálových biochemických analyzátorech. Nezbytnou součástí je pravidelná interní a externí kontrola kvality. V porovnání s tím je realizace tohoto vyšetření laboratorními „pololaiky“ (ať se na mě praktičtí lékaři nezlobí) na kazetkách či POCT analyzátorech (při vší úctě k jejich výrobcům) hazardem se zdravím pacientů či v lepším případě lze mluvit o vyšetření „na koleně“. POCT testy, které neposkytují kvantitativní výsledek, je nutno v současné době zavrhnout úplně.
Nová éra personalizovaných nádorových markerů
Jedním z nových přístupů k personalizované medicíně je využití tzv. personalizovaných nádorových markerů publikované prof. Diamandisem.7 Ten ve své práci definuje tzv. unikátní nádorový marker: Jde o marker s nízkou senzitivitou (5–30 %), ale vysokou specificitou (>95 %). Je to analogie tzv. exceptional responders v klinických studiích. Existují tisíce publikovaných markerů splňujících tuto definici. Prof. Diamandis a kol. mají záměr vytvořit veřejnou databázi těchto markerů, vyvíjejí a validují vysoce robustní analýzy pro stovky až tisíce analytů. Už nyní některé společnosti nabízejí multiplexové ELISA analýzy pro simultánní analýzu až 1 000 proteinů v 1,5 ml séra. Princip byl ověřen vyšetřením 1 000 molekul se vztahem k zánětu ve vzorcích pacientů s rakovinou slinivky před chirurgickým výkonem a po něm. Hypotéza: Molekuly, které dramaticky poklesnou po chirurgickém výkonu, mohou korespondovat s nádorovou masou a být slibnými nádorovými markery. Vyšetření markeru se provádí v séru před chirurgickým výkonem a po něm, přičemž se identifikuje 3–5 personalizovaných markerů, které nejlépe korelují s nádorovou masou (nejvýraznější změna po odstranění nádoru). Tyto markery se použijí pro personalizovanou monitoraci léčby a relapsu. Pro jejich stanovení bude dedikována specializovaná „centrální“ laboratoř, do níž se budou zasílat krevní vzorky mnoha pacientů z velké spádové oblasti (desítky milionů osob).7
Shrnutí
Závěrem bych chtěl zmínit také technologii umělé inteligence, která v blízké době dokáže propojit a integrovat různé datové vstupy (hodnoty klasických nádorových markerů, cfDNA, zobrazovací metody, digitalizované histologické preparáty apod.) a ve výsledku pomoci lékařům v diagnostice, určení optimálního léčebného postupu a sledování. První vlaštovkou v tomto směru je nedávno uvedený softwarový nástroj firmy ROCHE: NAVIFY Tumor Board, který poskytuje podporu pro klinická rozhodování. NAVIFY umožňuje lékařům shromažďovat takové údaje, jako jsou anamnézy pacientů, rentgenové snímky, zprávy z patologie a elektronické lékařské záznamy z různých zdrojů, a umístit je na jedné „elektronické nástěnce“. Tam je pak mohou společně procházet lékaři v jedné místnosti („onkotýmy“) i na různých místech světa pomocí vzdáleného přístupu. Tak je usnadněna integrace všech údajů a rozhodování o léčebných modalitách.16 Vyšetření nádorového onemocnění založené na tkáňové biopsii a zobrazovacích metodách budou již v blízké době vhodně doplňována také analýzou ctDNA. Tato metoda přináší řadu výhod, např. možnost častého odběru vzorků, detekce mutací v buňkách pocházejících z různých oblastí primárního nádoru i metastáz, monitorování vývoje a predikce odpovědi na léčbu. Za pomoci integrace všech výše uvedených modalit včetně klasických nádorových markerů pak bude možno individualizovat terapii jednotlivých pacientů na principu personalizované medicíny a tak dále zlepšovat naději na jejich vyléčení a zachování kvality života.