Úvod
SARS-CoV-2 (z angl. Severe Acute Respiratory Syndrome Coronavirus 2) je virus s vnějším obalem a jednovláknovou RNA z čeledi Coronaviridae. Koronaviry mají podobnou strukturu a jsou tvořeny 16 nestrukturálními a 4 strukturálními proteiny: hrotovým „spike“ (S) proteinem, proteinem obálky (E), membránovým (M) proteinem a nukleokapsidovým (N) proteinem. Koronaviry způsobují onemocnění, jehož symptomy sahají od příznaků mírné chřipky až po závažnější příznaky typické pro onemocnění koronavirem 2019 (COVID-19), způsobeného virem SARS-CoV-2.1,2
SARS-CoV-2 se přenáší mezi lidmi převážně prostřednictvím kapének z dýchacích cest, přičemž je možný také nepřímý přenos prostřednictvím kontaminovaného povrchu.3,4,5,6 Virus vstupuje do hostitelských buněk pomocí angiotenzin konvertujícího enzymu 2 (ACE2), který se vyskytuje zejména v plicích.7,8
Inkubační doba onemocnění COVID-19 je 2–14 dnů od expozice nákaze, přičemž se ve většině případů příznaky projeví přibližně za 4–5 dnů od expozice.3,9,10 Škála symptomů nákazy sahá od příznaků mírné chřipky (horečka, kašel, únava, ztráta čichu, zhoršené dýchání) až po příznaky velmi závažné.11,12 U většiny symptomatických pacientů však není průběh onemocnění vážný, k závažnému průběhu dochází zejména u starších dospělých nebo u dospělých, kteří trpí jinými zdravotními problémy a vyžadují intenzivní péči. U pacientů s vážným onemocněním je hlavní komplikací syndrom dechové tísně dospělých (ARDS). U pacientů v kritickém stavu typicky dochází např. k respiračnímu selhání, šoku anebo multiorgánové dysfunkci, nebo ke kolapsu.11,13,14
Konečná diagnóza onemocnění COVID-19 spočívá v přímé detekci SARS-CoV-2 RNA technikou amplifikace nukleových kyselin (NAAT).21,22,23 Imunochemické metody, které stanovují protilátky proti SARS-CoV-2, mohou přispět k identifikaci osob, u nichž se v minulosti vyskytla nákaza, a zhodnotit rozsah expozice populace, a tím pomoci v rozhodování o používání, vynucování nebo uvolňování opatření k zamezení jejího šíření.24
Přímá a nepřímá diagnostika SARS-CoV-2
Při podezření na infekci by měl být rychle odebrán a testován vzorek z horních cest dýchacích. Lze provádět výtěr z nosohltanu (preferováno) nebo výtěr z orofaryngu nebo výtěr z nosu. Vše pomocí speciální odběrové sady. Testování vzorků z dolních cest dýchacích je také doporučováno (sputum, bronchoalveolární laváž, endotracheální aspirát).4,49
Metoda NAAT15
Pro diagnostiku viru SARS-CoV-2 doporučuje WHO přímé stanovení virové RNA v odebraném vzorku pomocí amplifikačních testů (NAAT – Nucleic Acid Amplification Tests). Nejpoužívanější metodou je rRT-PCR (Real-time reverse transcription polymerase chain reaction), tedy PCR s reverzní transkripcí v reálném čase, která umí detekovat specifické sekvence virové RNA. Konkrétně se jedná o detekci genů E a RdRP. Validovaný diagnostický postup pro detekci viru SARS-CoV-2 dle WHO uvádí: (a) primární screening: detekce genu E, (b) potvrzující screening: detekce genu RdRP. Tzn. pozitivní detekce jednoho genu by měla být potvrzena druhým rRT-PCR testem zaměřeným na jiný gen viru SARS-CoV-2.49 Roche portfolio pro molekulární diagnostiku představuje několik možností PCR v reálném čase (rt-PCR).
Vyšetření protilátek5
Sérologické testy stanovující protilátky proti viru SARS-CoV-2 nejsou v současné době doporučovány pro diagnostiku COVID-19. Důvodem je jejich limitovaná výpovědní hodnota v akutní fázi infekce, protože protilátky vznikají až za určitou dobu po nákaze (obvykle za 7–10 dní).49 Protilátkový test se nejvíce využívá k určení imunitní reakce a séroprevalence. Roche nabízí metodu kvalitativní detekce protilátek IgG a IgM na přístrojích řady cobas e.
Vyšetření antigenu6,7
Testy detekují SARS-CoV-2 antigen prakticky ve stejných typech vzorků jako molekulární test. Tyto typy testů mají dobrou specificitu, ale ve srovnání s NAAT omezenou citlivost. Výhodami jsou téměř okamžitý výsledek a nižší náklady ve srovnání s NAAT.49 Roche bedlivě sleduje vývoj a potřeby zdravotnického systému v boji s epidemií. Díky tomu a své silné pozici ve vývoji inovativních diagnostik přináší potřebné prostředky adekvátní dané situaci.
Více aktuálních informací naleznete na:
https://www.ifcc.org/ifcc-news/
Přímý průkaz SARS-CoV-2 molekulárně biologickou metodou PCR v reálném čase (rt-PCR)
WHO doporučuje pro diagnostiku SARS-CoV-2 metody přímého stanovení virové RNA pomocí amplifikačních metod. Laboratorní diagnostika SARS-CoV-2 je založena na průkazu virové RNA pomocí molekulárně biologické metody PCR v reálném čase (rt-PCR).
Odběry pro detekci SARS-CoV-2:
- nasofaryngeální a orofaryngeální stěr;
- sputum (nedoporučuje se indukce sputa);
- endotracheální aspirát;
- bronchoalveolární výplach (BAL).
Roche možnosti laboratorní diagnostiky metodou NAAT:

- použít navazující automatické diagnostické přístroje, tzn. přístroje pro izolaci virové RNA a přístroje pro detekci SARS-CoV-2 pomocí PCR v reálném čase (rt-PCR). Izolaci virové RNA z různých odběrových materiálů lze provést pomocí přístrojů z řady MagNA Pure, konkrétně na systémech MagNA Pure 24 a MagNA Pure 96, a návazně provést detekci SARS-CoV-2 pomocí rt-PCR přístrojů v kombinaci s příslušnými MasterMixy, kontrolami a LightMix® kity. LightMixy pro konkrétní geny jsou od společnosti TibMolBiol a jsou validované pro různé typy těchto přístrojů, např. LightCycler® 480, LightCycler® 96 a cobas z 480. Společnost Roche, Diagnostics Division, ve spolupráci se společností TIB Molbiol (GmbH, Germany) nabízí testy, které jsou v souladu s doporučeními WHO pro detekci virové RNA. LightMixy detekují vybrané oblasti genu E nebo genu RdRP (RNA-dependentní RNA polymerázy). Pro screening jsou určeny kity pro detekci genu E k prokázání SARS-CoV-1 a SARS-CoV-2 spolu s dalšími viry příbuznými SARS. Pro potvrzení je určen kit pro detekci genu RdRP (RNA-dependentní RNA polymerázy) k potvrzení přítomnosti SARS-CoV-2 ve vzorku.
- pomocí manuálních izolačních kitů pro izolaci virové RNA, konkrétně lze použít kity HighPure Viral RNA Acid Kit a HighPure Viral NA Kit. Následně pak provést detekci SARS-CoV-2 pomocí rt-PCR přístrojů v kombinaci s příslušnými MasterMixy, kontrolami a LightMix kity.
- použití automatického velkokapacitního diagnostického systému pro kompletní analýzu vzorků cobas® 6800. V jednom přístroji probíhá izolace virové RNA a následně také detekce SARS-CoV-2 pomocí metody PCR v reálném čase (rt-PCR) bez nutnosti manuální intervence uživatele.
Více informací o přístrojích řady
MagnaPure a manuální izolační kity: https://www.lifescience.roche.com/
LightCycler®: https://lifescience.roche.com/
cobas® 6800: https://diagnostics.roche.com/
Konkrétní postupy a aktuální návody naleznete na portálu dialog.roche.com v sekci eSlužby/COVID-19
cobas® 6800 – automatický velkokapacitní diagnostický systém pro kompletní analýzu vzorku
Diagnostický systém cobas® 6800 využívá pro přímou diagnostiku COVID-19 tzv. duální test cobas® SARS-CoV-2, který detekuje dvě oblasti genomu SARS-CoV-2 (geny E a ORF1a/b) pro maximální specificitu. Test je certifikován EUA/CE-IVD. Kapacita systému je 1 440 vzorků denně (24hodinový pracovní provoz).
Požadavky na testování cobas® SARS-CoV-2:
• min. objem vzorku: 600 μl;
• typ vzorku: nasofaryngeální nebo orofaryngeální stěr;
• zkumavky:
- cobas® PCR Media tubes, cobas® PCR Media Dual Swab Kit, cobas® PCR Media Uni Swab kit – tyto zkumavky lze použít bez nutnosti přenosu vzorku do sekundární zkumavky, čímž se snižuje riziko kontaminace;
- Copan UTM-RT System, BD Universal Viral Transport Systém – zkumavky s nutností přenosu vzorku do sekundární zkumavky.
Charakteristika systému cobas® 6800:
- flexibilní, vysokokapacitní, plně automatizovaný systém pro izolaci nukleových kyselin s následnou amplifikací a detekcí infekčního agens (vše v jednom přístroji); minimalizuje nutné manuální kroky spojené s obsluhou;
- lze propojit s preanalytickými systémy a jedno- nebo oboustranně integrovat s různými typy LIS;
- v jednom běhu je možné provádět současně až 3 různé testy z jednoho vzorku;
- v jednom běhu lze měřit až 96 vzorků, včetně pozitivní a negativní kontroly;
- díky statimovému vstupu lze rychle a přednostně měřit vzorky s vysokou prioritou.

Portfolio testů systému cobas® 6800:
• test pro SARS-CoV-2;
• testování vzorků dárců krve a krevních složek:
- MPX test pro HIV, HCV, HBV;
- DPX test pro parvovirus B19 a HAV;
- CHIKV/DENV/Testy WNV, HEV;
• pohlavně přenosné choroby:
- HPV, CT/NG, TV/MG;
• infekční choroby a monitorování virové nálože:
- HIV-1, HBV, HCV, CMV, HIV-1/2 Qual
• transplantační vyšetření:
- EBV, BKV.
Doba trvání testu: první výsledky (96 vzorků) do 3,5 hod. od vložení do systému, každých dalších 90 min. přístroj generuje vždy dalších 96 výsledků.
Nepřímá diagnostika SARS-CoV-2 metodou kvalitativního stanovení protilátek
Elecsys® Anti-SARS-CoV-2 je plně automatizovaná imunochemická metoda pro in vitro stanovení protilátek (včetně IgG) proti viru SARS-CoV-2 v lidském séru a plazmě na analyzátorech řady cobas e. V rámci testu je použit rekombinantní protein, který reprezentuje nukleokapsidový (N) antigen, ve formátu sendvičového testu s dvojitým antigenem, jenž zvýhodňuje detekci vysoce afinitních protilátek proti SARS-CoV-2. Metoda umožňuje detekovat hladiny protilátek, které pozitivně korelují s neutralizačními protilátkami používanými v neutralizačních testech.43,44 Cílem testu je určení imunitní reakce na SARS-CoV-2.45
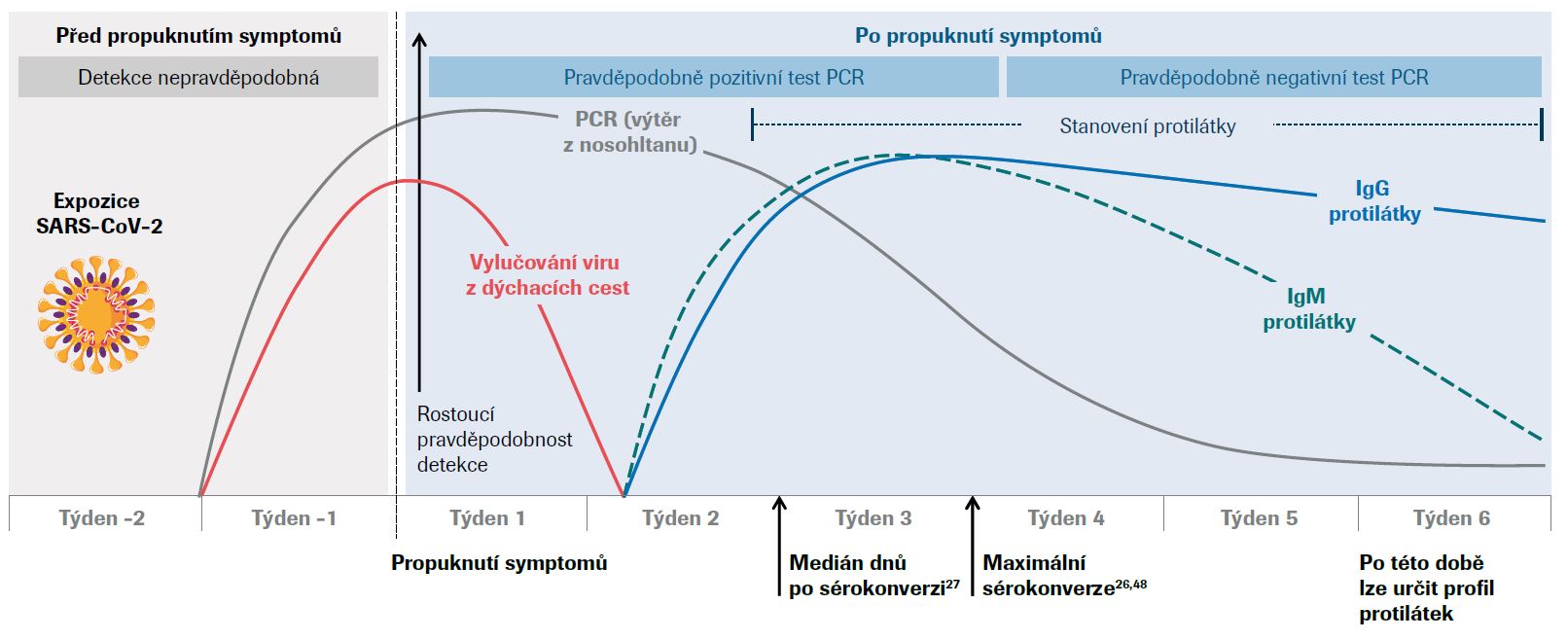
Imunitní odpověď při infekci koronavirem2
Při nákaze virem SARS-CoV-2 probíhá v těle hostitele imunitní reakce proti viru, která zahrnuje produkci specifických protilátek proti virovým antigenům. Protilátky typu IgM a IgG jsou zjištěny již 5 dnů po propuknutí příznaků.25,26 Medián sérokonverze je u IgM protilátek pozorován po 10–13 dnech a u IgG protilátek po 12–14 dnech od propuknutí příznaků,27,28,29 přičemž maximální hladiny protilátek jsou zjištěny ve 2. až 3. týdnu (IgM), ve 3. až 6. týdnu (IgG) a ve druhém týdnu v případě celkových protilátek.25,26,27,28,29,30,31
Zatímco protilátky typu IgM přibližně v 6. až 7. týdnu vymizí,32,33 u protilátek typu IgG je naopak v této době pozorována vysoká séropozitivita.25,32,33 I když je IgM obvykle hlavním typem protilátek vylučovaných do krve v raných fázích primární protilátkové odpovědi, úrovně a chronologické pořadí IgM a IgG protilátek se zdají být u SARS-CoV-2 viru vysoce variabilní. IgM a IgG protilátky proti viru SARS-CoV-2 se často objevují současně a v některých případech bylo vypozorováno, že se protilátky typu IgG objevily před IgM protilátkami, což omezuje jejich diagnostické použití.26,27,29,34,35
Po nákaze nebo očkování schopnost protilátek vázat antigen postupem času roste – tento proces se nazývá afinitní zrání.36 Vysoce afinitní protilátky mohou vyvolávat neutralizaci tím, že rozpoznávají a vážou konkrétní virové epitopy.37,38 Při nákaze virem SARS-CoV-2 se protilátky proti hrotovým (S) a nukleokapsidovým (N) proteinům, které vykazují vysokou neutralizační schopnost, vytváří již od devátého dne. Tento fakt naznačuje, že sérokonverze může vést k ochraně organismu alespoň po omezenou dobu.34,39,40,41,42
Elektrochemiluminiscenční imunoanalýza (ECLIA)
Princip testu: sendvičový test s dvojitým antigenem (celková doba stanovení: 18 minut)33
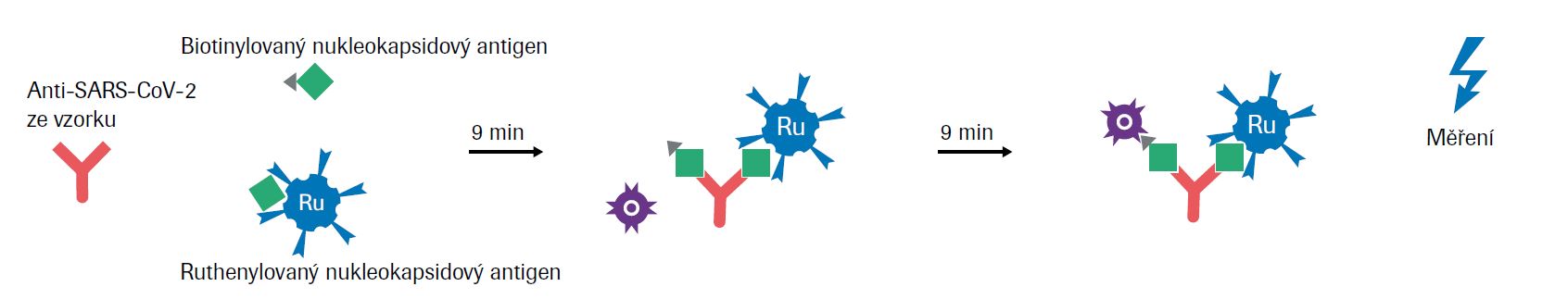
Krok 1 (9 minut)
Inkubace 20 μL* / 12 μL** vzorku odebraného pacientovi se směsí biotinylovaného a ruthenylovaného nukleokapsidového (N) antigenu. Za přítomnosti příslušných protilátek se vytvoří sendvičový double-antigen imunokomplex (DAGS).
* cobas e 411, e 601/602, ** cobas e 801
Krok 2 (9 minut)
Přidané mikročástice potažené streptavidinem se pevně navážou na komplexy DAGS interakcí biotinu a streptavidinu.
Krok 3 (měření)
Reakční směs je přenesena do měřicí cely, kde jsou mikročástice magneticky zachyceny na povrchu elektrody. Poté dojde k odstranění nenavázaných mikročástic. Přivedené napětí na elektrodě vyvolá chemiluminiscenční emisi, která je změřena fotonásobičem. Velikost signálu odpovídá vzestupu titru protilátek.
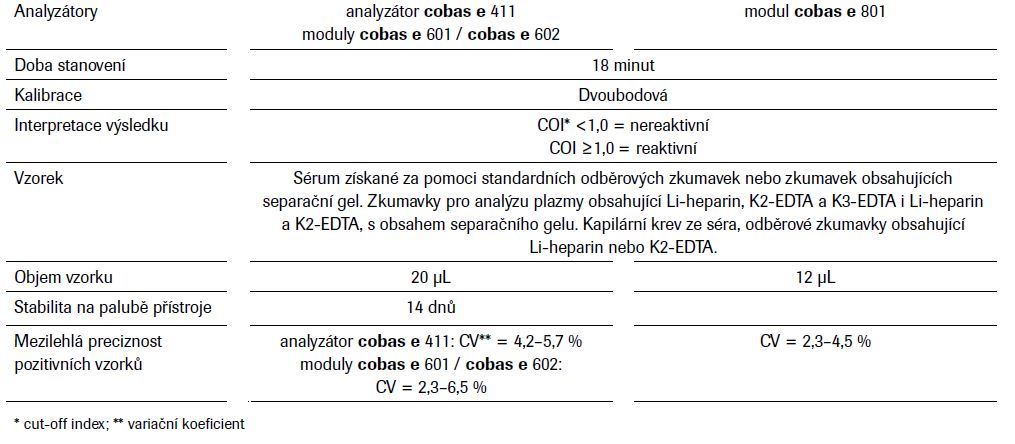
Elecsys® Anti-SARS-CoV-2 – analytické vlastnosti metody
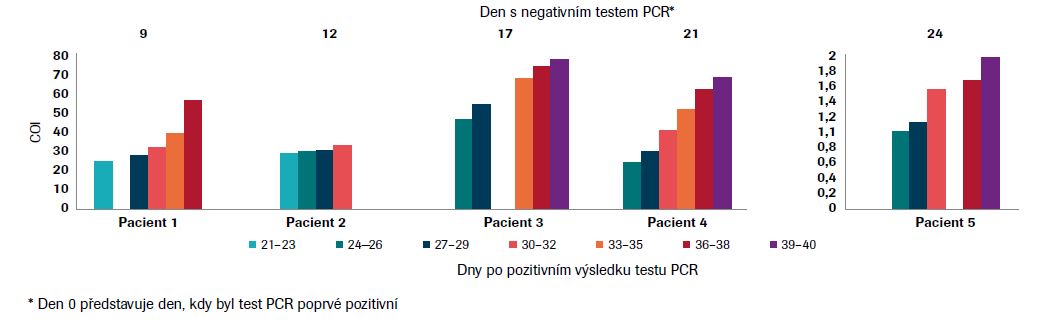
Senzitivita sérokonverze45
Po uzdravení z nákazy, které bylo potvrzeno negativním výsledkem PCR, bylo za pomoci testu Elecsys® Anti-SARS-CoV-2 vyšetřeno
26 následně odebraných vzorků od pěti osob.
Klinická senzitivita45
Testu Elecsys® Anti-SARS-CoV-2 bylo podrobeno celkem 496 vzorků od 102 pacientů s příznaky onemocnění, u nichž PCR test potvrdil nákazu virem SARS-CoV-2. Po potvrzení pozitivního výsledku PCR testu byl od těchto pacientů získán v různých časových intervalech jeden či více po sobě jdoucích vzorků.

Klinická specifičnost45
Celková specifičnost ve skupině 792 potenciálně zkříženě reaktivních vzorků byla 99,5 % (95 % CI = 98,63–99,85 %).

Klinická specifičnost45
Metodou Elecsys® Anti-SARS-CoV-2 bylo otestováno celkem 10 453 vzorků z rutinních vyšetření a od dárců krve, které byly získány v době před prosincem 2019.

Korelace s neutralizací séra45
U 46 klinických vzorků od jednotlivých pacientů bylo provedeno porovnání metody Elecsys® Anti-SARS-CoV-2 s neutralizačním testem založeným na VSV (vesicular stomatitis virus) pseudovirovém systému.46

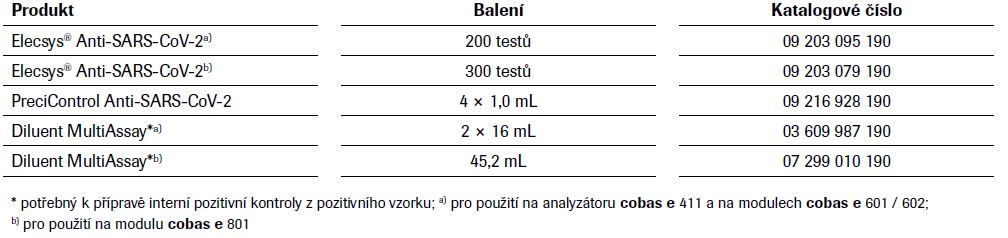
Informace k objednání
Roche s.r.o., Diagnostics Division
Na Valentince 3336/4, 150 00 Praha 5
www.roche-diagnostics.cz