Infekční hepatitida B je stále celosvětovým problémem, virem hepatitidy B je infikováno asi 400 milionů osob na celém světě, nejvíce v Asii, Africe a na Středním východě. Správná a rychlá diagnostika onemocnění a adekvátní terapie jsou důležité pro prognózu pacienta, především v případě přechodu hepatitidy B do chronické formy. V posledních letech se ukazuje, že kvantitativní stanovení HBsAg společně s vyšetřením HBV DNA je přínosem nejen pro určení prognózy pacienta, ale také pro správné vedení terapie chronické hepatitidy B.
Charakteristika viru hepatitidy B
Virus hepatitidy B (HBV) je z čeledi He-padnaviridae. Je tvořen parciálně dvojitou cirkulární DNA se čtyřmi otevřenými čtecími rámci pro kódování povrchového (surface) antigenu (HBsAg), vnitřního (precore/core) antigenu (HBcAg – nukleokapsidový a HBeAg – sekreční), polymerázy a proteinu X. HBV není cytopatogenní, jeho replikace nevede přímo k destrukci hepatocytu, poškození hepatocytu je způsobeno až imunitní odpovědí na přítomnost viru.
Akutní infekce HBV
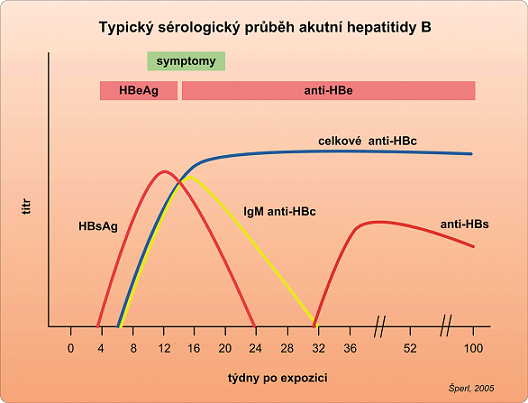
Replikace viru hepatitidy B začíná vazbou HBV k hepatocytu, v jádru hepatocytu se dokončí syntéza plus vlákna DNA, čímž se genomová struktura uzavře a vytvoří se „covalently closed circular“ DNA (cccDNA) (Šperl, 2005). Ta tvoří templát pro syntézu pregenomické RNA, která je přepsána do minus vlákna DNA. V jádru hepatocytu se pak vyskytuje cccDNA nejen z virionů vstupujících do buňky, ale také z HBV DNA nově syntetizované v cytoplazmě. V průběhu replikace viru HBV DNA se v infikovaných hepatocytech syntetizuje velké množství HBsAg a HBeAg, dochází ke spuštění imunitní reakce (za přítomnosti obou antigenů a HLA-I) a infikovaný hepatocyt je destruován. V tomto případě infekce virem hepatitidy B proběhne akutně. Klinicky se projeví po inkubační době 2 až 3 měsíců destrukce hepatocytů, zánětlivá odpověď a jaterní dysfunkce (zvýšení aminotransferáz). Kromě zvýšení aminotransferáz se v laboratorním nálezu objeví pozitivita HBsAg a HBeAg. Protilátky proti těmto antigenům (anti-HBc a anti-HBe) jsou vyvázány v imunokomplexech a do cirkulace se nedostávají. Prokazatelnými se v cirkulaci stávají až při poklesu replikace a poklesu syntézy HBsAg a HBeAg. HBc antigen se do krve nevylučuje, je přítomen navázán na membrány hepatocytů a protilátky (anti-HBc) jsou v krvi detekovatelné od počátku infekce. Typický sérologický průběh akutní hepatitidy B je na obrázku č. 1.
Chronická infekce HBV
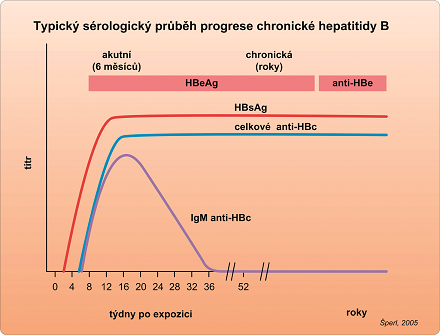
Infekce HBV je považována za chronickou v případě, že i po 6 měsících je v séru pacienta detekován HBsAg. Imunitní odpověď na replikaci viru je nedostatečná, nedochází tedy k destrukci napadených hepatocytů, není přítomná zánětlivě nekrotická odpověď. První fáze chronické hepatitidy B, „imunotolerance“, může přetrvávat i řadu let, kdy nejsou antigeny detekovány na povrchu hepatocytu, ale v cytoplazmě a jádru hepatocytu. Chronická hepatitida B pak přejde ze stadia „imunotolerance“ do dalšího stadia, „imunoclearance“. Je to imunoaktivní stadium chronické hepatitidy B, kdy dochází k opětovné expresi antigenů na povrchu hepatocytu, doprovázené zánětlivou odpovědí (vzestup ALT) a následnou fibrózou jater, cirhózou a možným vznikem hepatocelulárního karcinomu. V tomto stadiu je vhodné zasáhnout imunomodulační, nebo antivirovou terapií s cílem rychlého ukončení fáze imunoclearance a jejího převedení do další fáze „nízké replikace“, kdy dochází k sérokonverzi. V této fázi ustává replikace viru, je nízká exprese genů virových antigenů na membránách hepatocytů. Sérologicky se to projeví mizením HBsAg a HBeAg v cirkulaci a objevením se protilátek – nejprve anti-HBe a pak ve stadiu HBsAg negativity také anti-HBs. Fáze chronické hepatitidy B a jejich sérologický profil je v tab. 1 a na obr. 2.
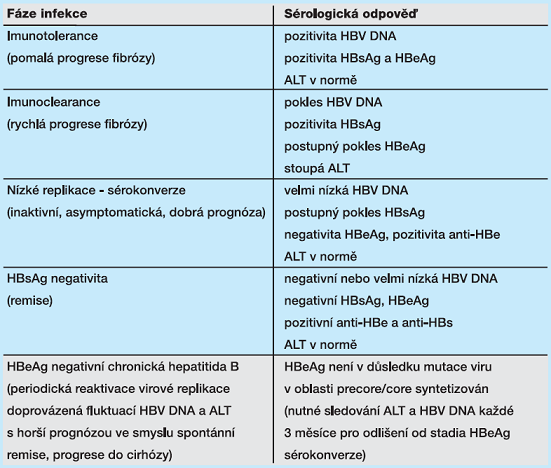
V případě bodové mutace genu viru hepatitidy B v oblasti precore/core může mít chronická hepatitida B nepříznivější vývoj, dochází k přechodu do HBeAg negativní formy chronické hepatitidy B. Mutovaný virus produkuje pouze HBcAg a neprodukuje HBeAg. Tato forma hepatitidy je doprovázena vyšší zánětlivou reakcí a horší terapeutickou odpovědí (viz tabulka 1). U 20 až 30 % pacientů s akutní hepatitidou B po spontánní sérokonverzi s HBeAg negativitou může dojít k reaktivaci viru a progresi onemocnění do chronické hepatitidy (Tseng, 2011).
Léčba chronické virové hepatitidy B
Terapie chronické hepatitidy B je zaměřena na dosažení co nejrychlejšího přechodu onemocnění do fáze nízké replikace viru se sérokonverzí. V současné době jsou možné dva postupy. Tím prvním je časově omezená terapie – cílem je dosažení sérokonverze a poklesu virémie pod 2 000 IU/ml, které trvá i po ukončení terapie. K této terapii se používá zejména imunomodulátor interferon α (pegylovaný interferon α). Koncentrace HBsAg výrazněji klesá při terapii interferony v porovnání s terapií nukleosidovými analogy, které jsou především potentními inhibitory HBV DNA replikace (Peignoux, 2013). V případě, že se časově omezenou terapií nepodaří dosáhnout sérokonverze nebo setrvalé virologické odpovědi, jsou pacienti indikováni k dlouhodobé, časově neomezené léčbě s cílem suprimovat virémii a dosáhnout zpomalení progrese onemocnění. V těchto případech se dnes používají léky s vysokou genetickou bariérou proti rezistenci, entekavir a tenofovir. Léčba lamivudinem a adefovirem jako léky první volby by neměla být zahajována z důvodu vysokého rizika vzniku rezistentních mutací (Fraňková, Šperl, 2014).
V roce 1965 Blumber označil HBsAg za otisk pro diagnózu hepatitidy B. Zatímco kvalitativní stanovení HBsAg přináší informaci o etiologii onemocnění, HBsAg kvantita je markerem prognózy (stratifikace rizika, progrese onemocnění) a terapeutické odpovědi na antivirovou terapii u pacientů s chronickou hepatitidou B. Kvantita HBsAg se v průběhu chronické hepatitidy B mění, nejvyšší je ve fázi imunotolerance (5,0 log10 IU/ml), pokles začíná s přechodem do fáze imunoclearance (3,0–4,0 log10 IU/ml) a dále pokračuje až do fáze sérokonverze (Gheorgija, 2013). Nejnižší koncentrace jsou pozorovány u inaktivních nosičů, ale vyšší než u těch pacientů, kteří mají HBeAg negativní formu hepatitidy B. Je známo, že kvantita HBsAg se signifikantně liší také podle HBV genotypu. Pacienti s genotypem A a D mají vyšší koncentrace v porovnání s genotypem B a C (Sonneveld, 2013). Udává se, že kvantita HBsAg lépe reflektuje transkripční aktivitu cccDNA než počet kopií cccDNA (Chan, 2011).
Studie z posledních let ukazují, že kvantita HBsAg se v průběhu chronické hepatitidy B mění (viz výše) a mění se také v důsledku probíhající terapie. Při terapii pegylovanými interferony (48 týdnů) poskytuje stanovení kvantity HBsAg možnost „response-guided“ terapie (Peignoux, 2013). Je důležité identifikovat jedince s dobrou tolerancí a efektem terapie a pacienty s rizikem relapsu po ukončení terapie. Cílem terapie je dosažení dobré virologické i imunologické odpovědi.
Respondenti k terapii peginterferonem alfa vykazují větší pokles HBsAg v porovnání s nonrespondenty. Optimální cut-off HBsAg u pacientů v terapii peginterferonem, který predikuje dobrou terapeutickou odpověď u pacientů s HBeAg pozitivní hepatitidou B, by mohl být 20 000 IU/ml ve 12., nebo 24. týdnu terapie (Tseng, 2012). Jiný může ovšem být postup u pacientů s HBeAg negativní formou hepatitidy (viz níže). V klinické praxi by se měla kvantita HBsAg vyšetřovat společně s HBV DNA, nemá ji ovšem ve vyšetřování nahradit (Chan, 2011).
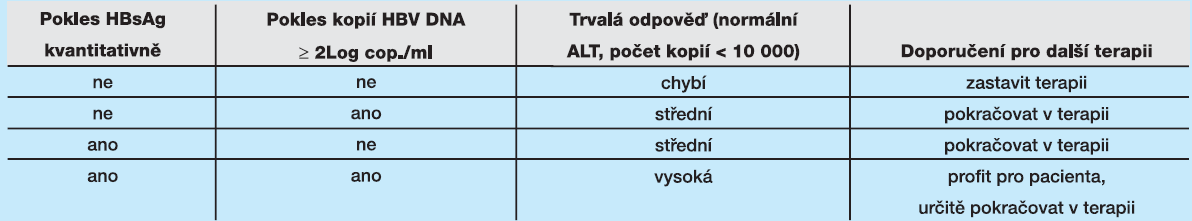
V roce 2010 byla v Hepatology publikována studie Rijckborsta a kolektivu, která se zabývala terapií pacientů s HBeAg negativní formou chronické hepatitidy B pomocí pegylovaného interferonu. Autoři se zaměřili na roli kvantitativního stanovení HBsAg v predikci trvalé odpovědi na léčbu (72 týdnů po zahájení terapie normální ALT a kvantita menší než 10 000 IU/ml). Do studie bylo zahrnuto 107 pacientů, 24 z nich dosáhlo trvalé odpovědi na terapii. Kvantita HBsAg markantněji klesla u respondentů v porovnání s nonrespondenty. Tabulka 2 ukazuje, že kombinace časné (ve 12. měsíci terapie) kvantifikace HBsAg a HBV DNA je nejvhodnějším selekčním kritériem pro terapii peginterferonem alfa-2a u pacientů s HBeAg negativní formou chronické hepatitidy. Selektují se pacienti, u kterých další pokračování terapie (48 týdnů celkově) nepřinese pro pacienta benefit, a je tedy vhodné terapii změnit na léčbu nukleot/sidovými analogy.
Kvantita HBsAg může predikovat odpověď na terapii peginterferonem a limitovaně. Sonneveld a kolektiv analyzovali skupinu 803 pacientů s HBeAg pozitivní chronickou hepatitidou B (Sonneveld, 2011). Autoři uzavírají, že kvantita HBsAg je silným prediktorem odpovědi na terapii peginterferonem a u pacientů s HBeAg pozitivní chronickou hepatitidou B, ale poukazují na rozdíly v genotypech s možností různých „stopping-rules“ ve 12. týdnu terapie. Pro všechny genotypy je však přerušení terapie indikováno, pokud je koncentrace HBsAg po 24 měsících terapie větší než 20 000 IU/ml (Sonneveld, 2011). Obecně lze lepší odpověď na terapii očekávat u pacientů s HBV s genotypem A a B v porovnání s genotypem C a D a také u pacientů s vyšším ALT a nízkou hladinou HBV DNA. Je třeba další studie a dalšího pozorování k vyjasnění definitivní role stanovení HBsAg u pacientů s chronickou hepatitidou B z hlediska prognózy onemocnění a především z hlediska vedení terapie interferonem alfa.
Vlastní zkušenosti se stanovením HBsAg kvantitativně
Na PLM IKEM stanovujeme kvantitu HBsAg od roku 2013 diagnostickou soupravou HBsAg II quant firmy Roche. Vyšetřili jsme soubor 102 pacientů sledovaných a léčených v IKEM pro HBV infekci. V souboru bylo 38 žen a 64 mužů. Věk byl v rozsahu 22–81 let, medián věku mužů (50, interkvartilové rozpětí 42–62) se nelišil od mediánu věku žen (49, interkvartilové rozpětí 43–60). Část pacientů byla vyšetřena opakovaně, takže bylo celkem k dispozici 129 vyšetření (z toho 56 u žen a 73 u mužů). Ve skupině bylo zařazeno 20 pacientů po transplantaci ledviny, 2 pacienti po transplantaci srdce a 1 pacient po kombinované transplantaci ledviny a pankreatu. Všichni tito pacienti užívali protivirovou léčbu. Dvacet jedna pacientů (20,6 %) mělo na počátku léčby HBeAg pozitivní formu chronické hepatitidy B, ostatní byli HBeAg negativní.
Z uvedeného souboru sledovaných nemocných bylo protivirově léčených 86 (84,3 %). Šestnáct pacientů bylo ve stadiu reziduální replikace viru a nesplňovali tudíž kritéria k zahájení protivirové léčby (HBV DNA < 2000 IU/ml u HBeAg negativní formy onemocnění). Jedna nemocná (HBeAg pozitivní) byla léčena peginterferonem alfa-2a, ostatní pacienti dostávali časově neomezenou léčbu nukleotidovými či nukleosidovými analogy, v monoterapii nebo v kombinaci při průkazu rozvoje rezistence na dříve podávané antivirotikum. Třicet dva nemocných bylo léčeno monoterapií entekavirem, 28 pak tenofovirem v monoterapii. Lamivudin v monoterapii užívali pouze 4 nemocní, u kterých dosud nevznikla k léku rezistence. Dvojkombinací lamivudinu a tenofoviru bylo léčeno 10 pacientů, kombinací lamivudinu a adefoviru 6 pacientů. Entekavir v kombinaci s adefovirem dostával 1 pacient, dosud nejúčinnější kombinaci tenofoviru a entekaviru bylo nutno zahájit u 4 nemocných s nedostatečnou supresí virémie při léčbě monoterapií. U všech léčených nemocných vedla podávaná terapie k adekvátní supresi virémie (dosažení úplné negativity HBV DNA nebo hodnot HBV DNA pod mezí kvantitativního rozlišení metody, tj. 20 IU/ml).
S rostoucí hodnotou replikace viru (pozitivita HBV DNA) se zvyšuje HBsAg kvant. (p<0,01), ale u části pacientů s negativní HBV DNA (přibližně polovina souboru, tj. 62/129) je zvýšená hodnota HBsAg kvant: čtvrtina pacientů s negativní HBV DNA má HBsAg nad 3500 a 10 % pacientů s negativní HBV DNA má HBsAg nad 17 500 kIU/l. U pacientů s HBsAg nad 500 kIU/l zaznamenáváme vyšší hodnotu aktivity ALT (p=0,084, N.S.). Ženy měly signifikantně nižší hodnoty ALT (p<0,001), ale nebyl žádný rozdíl v hodnotách HBsAg kvant. nebo HBV DNA mezi muži a ženami. Charakteristika souboru je ovlivněna selekcí pacientů, kdy u mladších jedinců byly závažnější průběhy onemocnění: mladší jedinci měli signifikantně vyšší HBsAg kvant. (p<0,001), pozitivní HBeAg (p<0,01) i pozitivní HBV DNA (p<0,05). Tento pilotní přehled nemůže mít dosud ambice na zhodnocení klinického významu kvantitativního stanovení HBsAg v našem souboru vzhledem ke krátké době hodnocení kvantitativní hodnoty HBsAg. Většina pacientů je sledována v půlročních intervalech, a proto nemůžeme zatím hodnotit jeho vývoj v čase u jednotlivých nemocných v závislosti na podávané léčbě. Ve sběru dat pokračujeme a výsledky vyhodnotíme podrobně v návaznosti na použitou terapii a fázi onemocnění.
Autorky děkují ing. Štěpánce Strnadové za technickou pomoc.