Kvalitativní rychlotesty na detekci protilátek proti novému typu koronaviru SARS-CoV-2 na principu laterální imunodifúze jsou postupně nahrazovány přesnějšími testy kvantitativní detekce protilátek pomocí automatické imunoanalýzy. Některé tyto testy detekují protilátky třídy IgM, IgG, příp. IgA. Nejspolehlivější pro průkaz prodělané infekce je detekce celkových protilátek proti danému epitopu nebo protilátek třídy IgG, jejichž produkce organismem po prodělané infekci SARS-CoV-2 je nejrobustnější, jelikož u některých jedinců nejsou anti-SARS-CoV-2 protilátky třídy IgM detekovány.1,2
Nejvíce imunogenními antigeny nového typu koronaviru SARS-CoV-2 jsou protein N a protein S.3,4 Nukleokapsidový protein N je jediný protein, který tvoří nukleokapsid virionu SARS-CoV-2. Je vysoce fosforylovaný, hydrofilní, což vede k vysoké afinitě k virové RNA, a také stojí za imunogenicitou proteinu N. Protein S (Spike) je transmembránový protein virionu SARS-CoV-2 zodpovědný za vnik virionu do buňky. Glykoprotein S se skládá ze dvou podjednotek. Podjednotka S1 s RBD (receptor-binding domain) interaguje s receptorem ACE2 na povrchu hostitelských buněk, S2 doména obsahuje transmembránovou část proteinu.
Protilátky proti nukleokapsidovému proteinu N je možné detekovat pomocí elektrochemiluminiscence (ECLIA) na principu double-antigen sandwich imunoanalýzy testem Elecsys® Anti-SARS-CoV-2. Tento test je kvalitativní, hodnotí se v jednotkách poměru s cut-off COI, přičemž hodnoty 1,0 COI a vyšší jsou dle doporučení výrobce považovány za pozitivní. Protilátky proti proteinu S je možné detekovat pomocí elektrochemiluminiscence (ECLIA) na principu double- -antigen sandwich imunoanalýzy testem Elecsys® Anti-SARS-CoV-2 S. Tento test je kvantitativní, hodnotí se v jednotkách U/mL, přičemž hodnoty 0,8 U/mL a vyšší jsou dle doporučení výrobce považovány za reaktivní. Rozsah měření tohoto testu je 0,4–250 U/mL a vzorky s vysokou hladinou anti-S protilátek se ředí 1 : 10 univerzálním diluentem. Výsledky v pásmu nereaktivní jsou převážně s hladinou pod detekční limit 0,4 U/mL. Oba protilátkové testy detekují celkové protilátky bez rozlišení třídy a jsou určeny pro detekci protilátek ze všech standardních typů klinických vzorků, tj. sérum, Li-heparin plazma, K2/K3-EDTA plazma, plazma z krve odebrané do citrátu sodného.
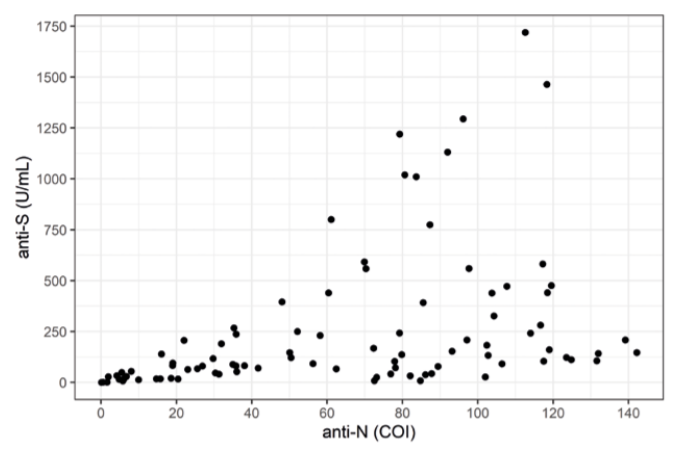
Měli jsme možnost analyzovat vzorky pacientů se závažným až kritickým průběhem a vzorky dospělých pacientů s mírným nebo bezpříznakovým průběhem. Všechny vyšetřované vzorky byly odebrány do K3-EDTA. Ačkoli je test Elecsys® Anti-SARS-CoV-2 (anti-N) kvalitativní, poskytuje hodnoty přes dva řády COI (naše nejvyšší naměřená hodnota byla přes 140 COI). Pro účel této studie jsme proto výsledky anti-N protilátek hodnotili kvantitativně. Vztah mezi anti-N a anti-S protilátkami je patrný z obr. 1. Hodnoty nejsou nezávislé, ale silná lineární či jiná korelace mezi hodnotami není. Od hladiny celkových anti-N na úrovni přibližně 60 COI je variabilita párových hodnot anti-S značná, a to od koncentrace v pásmu nereaktivní po koncentraci přes 1 000 U/mL (viz obr. 1).
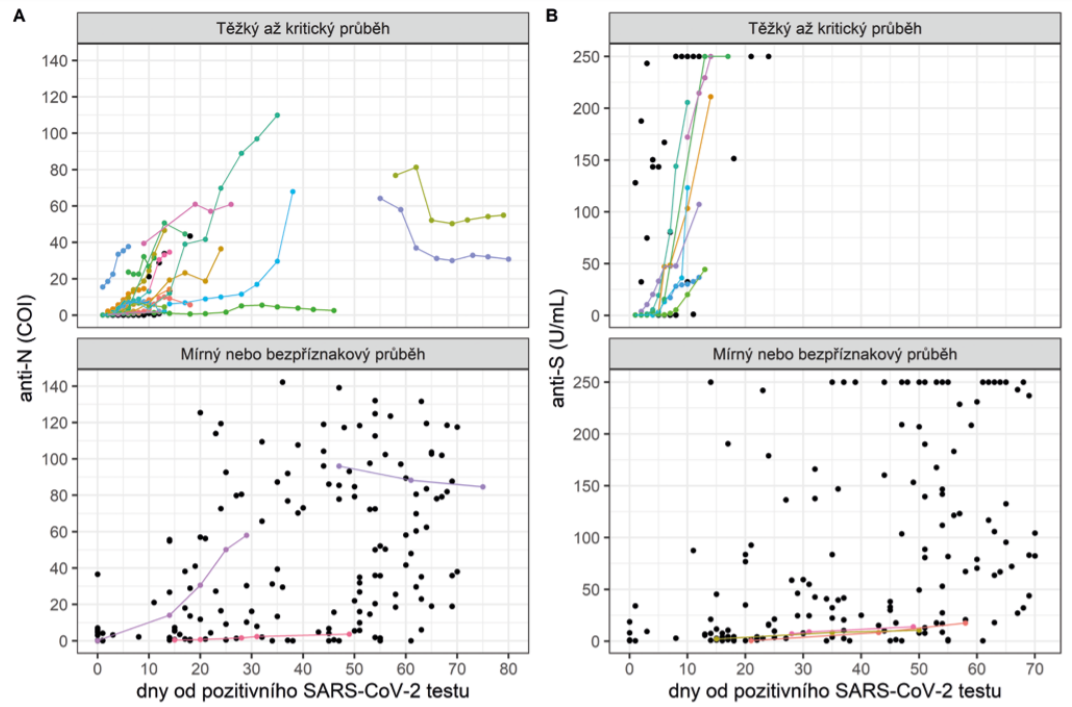
V časovém průběhu hladin anti-N protilátek, u kterých byl delší follow-up z důvodu dřívější dostupnosti testu, jsme pozorovali nástup a pak následně pokles hladin anti-N protilátek (viz obr. 2). Co se týče nástupu produkce protilátek anti-S, je zřejmý zásadní rozdíl v závislosti dynamiky produkce na tíži příznaků (viz obr. 2). U jedinců s mírným průběhem onemocnění je obecně nástup produkce protilátek anti-S pozvolnější než u pacientů s těžkým či kritickým průběhem COVID-19 (viz obr. 2). U některých jedinců nedosahuje hladina pásma reaktivní ani po 5 týdnech od první PCR pozitivity SARS-CoV-2. Příklady jsou následující: žena, 47 let, mírný průběh onemocnění, pozitivita zjištěna na počátku října 2020. Metodou Elecsys® Anti-SARS-CoV-2 S u ní byla 21 dní od zjištění nákazy detekována hladina protilátek 0,562 U/mL, 43 dní od zjištění nákazy již byla tato hodnota 8,35 U/mL. U ženy, 26 let, s velmi mírným průběhem, byla nákaza prokázána na konci října 2020. Dvacet jedna dní po tomto zjištění u ní byla toutéž metodou stanovena hladina protilátek 0,576 U/mL, po dalších 15 dnech (35 dní od zjištění nákazy) byla hladina anti-S protilátek 3,84 U/mL. Posledním příkladem je opět žena, 43 let, mírný průběh onemocnění, pozitivita na konci září 2020. Dvacet dní od zjištění nákazy byla hladina anti-N protilátek v pásmu nereaktivní 0,724 COI, anti-S protilátky v této době nebyly stanovovány. Za dalších 8 dní už anti-N protilátky překročily cut-off hodnotu reaktivity a dosáhly hladiny 1,66 COI, hladina anti-S protilátek byla v této době (28 dní od prokázané pozitivity) 7 U/mL. Podobných případů jsme zaznamenali více. Z našich zkušeností vyplynulo, že již hodnoty anti-SARS-CoV-2 S mezi detekčním limitem 0,4 U/mL a cut-off hodnotou pro reaktivitu, tj. 0,8 U/mL, mohou signalizovat počínající produkci protilátek proti S-proteinu. Na pracovišti Oddělení klinické mikrobiologie a imunologie ÚLM FN Brno reportujeme hodnoty nad 0,5 U/mL jako hraniční s interpretací dle klinického kontextu a s doporučením provést vyšetření opakovaně s časovým odstupem 2–4 týdnů.
Těžiště významu kvantitativního stanovení anti-SARS-CoV-2 protilátek spočívá aktuálně v problematice rekonvalescentní plazmy, tj. hyperimunní krevní plazmy od rekonvalescentů infekce SARS-CoV-2. Podání anti-SARS-CoV-2 protilátek obsažených v plazmě vyléčených osob představuje způsob pasivní specifické imunizace s očekávatelnou léčebnou odpovědí.5 Účinnost pasivní imunoterapie závisí na množství protilátek přítomných v podávané krevní plazmě. Užití rekonvalescentní covidové plazmy v České republice upravuje doporučení Doporučený postup pro použití rekonvalescentní plazmy v léčbě dospělých pacientů s COVID-19.6 Minimální množství anti-SARS-CoV-2 protilátek je aktuálně definované titrem protilátek stanoveným SARS-CoV-2 specifickým virus neutralizačním testem (VNT). Ve verzi 1 doporučení z 30/04/2020, vycházející z doporučení Evropské komise v té době aktuálního,7 se za žádoucí a efektivní doporučuje titr 1 : 320 a více. Druhá verze doporučení EK z 30/11/20208 již jednoznačnou minimální hladinu virus neutralizačních protilátek nedoporučuje vzhledem k doposud nedostatečné klinické evidenci. V doporučení je uveden s odkazem na dosavadní výsledky9,10 a praxi ve Spojených státech titr minimálně 1 : 160, který bude dále ověřován v klinických hodnoceních. V doporučení EK8 je navrženo vyšetřovat potencionální dárce rekonvalescentní plazmy pomocí kvantitativního testu na anti-SARS-CoV-2 protilátky s dobrou návazností na virus neutralizační test, jehož praktická proveditelnost je limitovaná s ohledem na délku testu a dostupnost omezenou pouze na pracoviště BSL3, která jsou nositelem povolení pro práci s nebezpečnými infekčními agens včetně SARS-CoV-2.
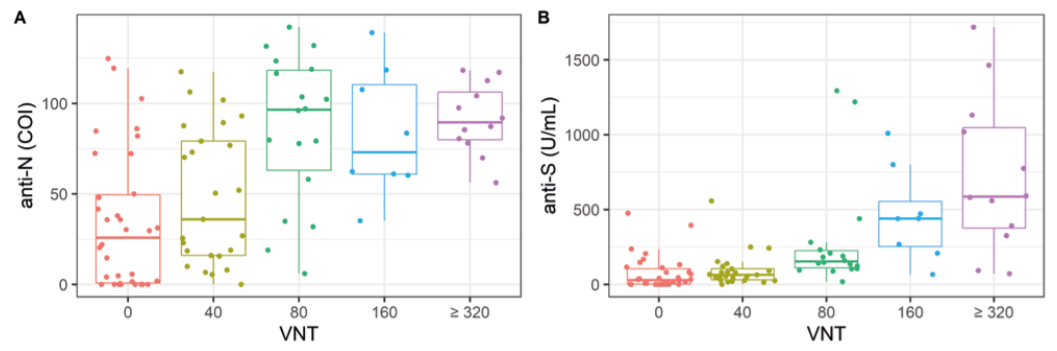
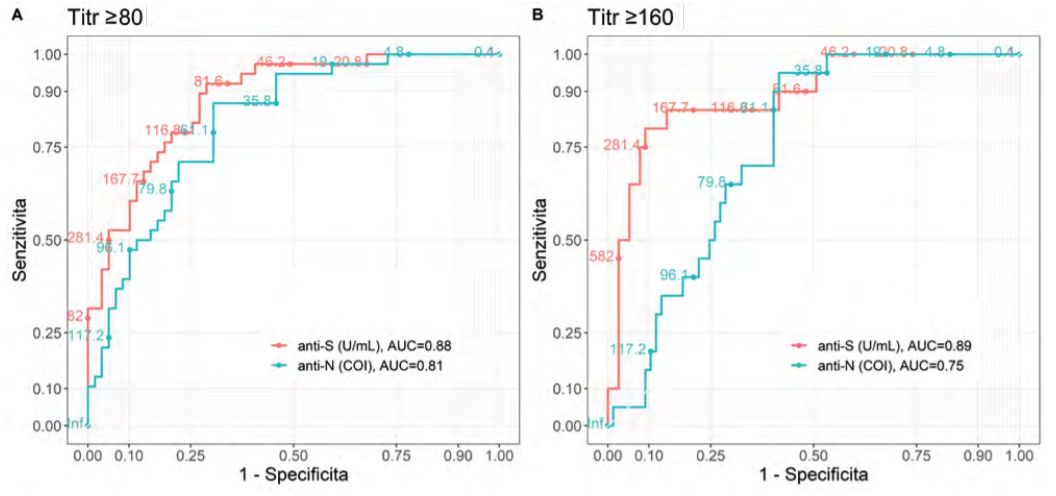
Otázka výběru potenciálních dárců rekonvalescentní plazmy vyvstala i ve FN Brno ve chvíli, kdy se zahajovala výroba rekonvalescentní covidové plazmy na TTO. Měli jsme možnost provést zhodnocení vztahu hladiny titrů VNT stanovených v Centru biologické ochrany a hladiny anti-SARS-CoV-2 protilátek cílících na N nebo na S epitop na kohortě 97 jedinců, kteří prodělali COVID-19 a/nebo byli infikováni SARS-CoV-2 na jaře 2020 a jejichž vzorky byly získány na začátku léta 2020. SARS-CoV-2 specifický virus neutralizační test byl proveden následujícím způsobem: do jamek mikrotitračních destiček s buňkami VERO E6 byla přidána inkubovaná směs viru SARS-2-CoV s testovaným vzorkem ve dvojkovém ředění. Pokud jsou přítomné neutralizační protilátky, zabrání infikování buněk, a tím vzniku cytopatického efektu. Test je hodnocen mikroskopicky 4. den inkubace. U obou automatizovaných protilátkových testů jsme pozorovali vztah mezi stanovenou úrovní a VNT titrem (viz obr. 3). Provedená ROC analýza cílící na titr minimálně 1 : 80 ukázala, že analytické parametry pro rozlišení vzorků s presumptivním titrem protilátek automatizovanou metodou jsou mírně vhodnější u anti-S testu s plochou pod křivkou AUC = 0,88, přičemž AUC pro anti-N metodu byla 0,81 (viz obr. 4A). Pokud cílíme na VNT titr 1 : 160, ROC analýza opět ukazuje, že anti-S protilátky jako marker SARS-CoV-2 neutralizačního potenciálu jsou vhodnější (s AUC = 0,89) oproti anti-N protilátkám (AUC = 0,75), viz obr. 4B.
Pro výběr vzorků s titrem VNT minimálně 1 : 160 jsou cut-off hodnoty pro automatizované protilátkové testy následující:
(i) při specificitě aspoň 85 % a maximální senzitivitě anti-S 209 U/ml a anti-N 104 COI a
(ii) při specificitě aspoň 90 % a maximální senzitivitě anti-S je to 268 U/ml a anti-N 118 COI. Vztah mezi Elecsys® Anti-SARS-CoV-2 (anti-N) protilátkami a virus neutralizačními protilátkami byl popsán.11,12 Možnost selekce dárců rekonvalescentní plazmy na základě kvantifikace anti-S protilátek byla popsána pro imunoanalytický systém Ortho VITROS.13
Z této prezentované ministudie vyplývá, že
(i) Elecsys® Anti-SARS-CoV-2 a Elecsys® Anti-SARS-CoV-2 S testy zachycují anti-SARS-CoV-2 protilátky, které mají rozdílnou dynamiku u téhož jedince,
(ii) produkce anti-S protilátek má vysokou interindividuální variabilitu a produkce těchto protilátek u jedinců s mírným či bezpříznakovým průběhem může být velmi pozvolná,
(iii) oba testy korelují s virus neutralizačním potenciálem plazmy rekonvalescentů, přičemž u anti-S protilátek je korelace silnější a tento test může sloužit pro rychlou a praktickou preselekci dárců SARS-CoV-2 rekonvalescentní plazmy.
Práce byla podpořena CZECRIN LM2018128.
Poděkování
Na pracích vedoucích k této publikaci dále spolupracovali: Iveta Selingerová2,3, Dominika Okruhlicová2, Hana Kabíčková4, Petr Pajer4, Hana Lejdarová5,6, Rita Pacasová5,6, Vladimír Šrámek7, Martin Helán7, Lenka Gescheidtová3, Dalibor Valík2,6
Farmakologický ústav2, LF MU, Oddělení laboratorní medicíny3, Masarykův onkologický ústav, Vojenský zdravotní ústav4, Transfuzní a tkáňové oddělení5, FN Brno, Katedra laboratorních metod, LF MU6, Anesteziologicko resuscitační klinika, LF a FN u sv. Anny7