Jak dále v diagnostice sepse?
V uplynulých letech byla publikována celá řada originálních prací a přehledových review o biomarkerech sepse.1,2 Závěr je jednoznačný – v současnosti nemáme dostatečně senzitivní a specifický parametr pro infekční zánět. Přitom ale transkriptomické studie prokázaly, že genová exprese u infekčního a neinfekčního zánětu je rozdílná.3,4 V čem je tedy problém? Je to aktuální dostupnost parametrů, které jsme schopni měřit v plazmě nebo séru a které by měly být specifické jen pro infekční zánět. Tato dostupnost je mimo jiné určena technologiemi, které při stanovení těchto biomarkerů používáme.
Jaká je současná situace v diagnostice sepse? Při diagnostice sepse uplatňujeme dva přístupy, které se navzájem doplňují. Ten první provádí detekci biomarkerů spojených se zánětlivou reakcí organismu na infekci, ten druhý přímou diagnostiku infekčního agens. V obou případech narážíme na řadu problémů. V prvním případě nemáme dosud k dispozici parametr, který by byl specifický pro infekční etiologii. Sepse je definována jako nepřiměřená imunitní reakce na infekci. Co by tedy měly ukazovat biomarkery sepse? Měly by definovat nebo interpretovat tuto nepřiměřenou imunitní reakci. Jaká je realita, resp. naše současné možnosti? Jsme schopni zjistit a měřit zánětlivou aktivitu organismu, kde nejvíce používanými a měřenými markery sepse v klinické praxi jsou prokalcitonin a C-reaktivní protein.5,6 Pomocí těchto parametrů stanovujeme a měříme intenzitu zánětlivé odpovědi, která ale není specifická jen pro infekční etiologii. Celá řada neinfekčních onemocnění je spojena s elevací těchto biomarkerů. Autoimunitní, kardiologická onemocnění, ale i iatrogenní působení, jako jsou operační zákroky nebo imunoterapie, jsou asociována se zvýšením těchto parametrů.7,8,9 Stanovení prokalcitoninu a C-reaktivního proteinu patří dnes ke zlatému standardu v diagnostice sepse, ale u žádného z nich není senzitivita a specificita dostatečná. Stále se pohybuje mezi 70 a 85 %, což znamená, že každý pátý vzorek je falešně pozitivní nebo falešně negativní. Z dalších užitečných parametrů je to stanovení IL-6. Interleukin-6 představuje jeden z nejdůležitějších prozánětlivých cytokinů se širokou škálou účinků jak za fyziologických, tak patologických podmínek.10 V diagnostice kriticky nemocných jej využíváme pro rozlišení infekční a neinfekční etiologie syndromu systémové zánětlivé odpovědi, nebo pro měření intenzity prozánětlivé aktivity a k predikci klinického výsledku.11,12 Možnost jeho měření ve statimovém režimu je důležitým předpokladem jeho širokého použití v klinické praxi.
Druhým nedílným přístupem je diagnostika infekčního agens pomocí mikrobiologických klasických kultivačních nebo molekulárně biologických metod. Přestože indikace antibiotické terapie během první hodiny onemocnění již není absolutně spojována s klinickým průběhem a mortalitou onemocnění, včasné nasazení antibiotik stále zůstává prioritou.13 V případě přímého průkazu infekčního agens nám současné mikrobiologické vyšetřovací metody podstatným způsobem zkrátily čas nezbytný k diagnostice, ale stále ne v dostatečné míře. A jsou zde další limity – detekce anaerobních bakterií, špatně kultivovatelných infekčních agens aj. Metody molekulární biologie dokážou ve velmi krátkém časovém intervalu zjistit přítomnost infekčních agens, ale jsou zde jiná omezení, např. nemožnost stanovení citlivosti na antibiotika.
Dostupnost a senzitivita metod
U sepse stále platí a bude platit, že rychlost její diagnostiky hraje zásadní roli pro klinický výsledek. Vyšetřování biomarkerů sepse musí být dostupné 24 hodin denně ve statimovém režimu. Pokud se podíváme na technologie, které v současnosti využíváme pro jejich detekci, jedná se o turbidimetrii nebo nefelometrii, popřípadě imunostanovení. Můžeme konstatovat, že za posledních 20 let nebyl objeven žádný nový parametr, jehož stanovení by přineslo zásadní pokrok při diagnostice sepse.
Nové možnosti nám ale nabízí využití metod molekulární biologie – konkrétně proteomiky, se stanovením parametrů, které nejsou detekovatelné aktuálně používanými metodami. Tyto nově nalezené markery můžeme měřit metodou hmotnostní spektrometrie, s relativně nízkými provozními náklady. Příkladem může být stanovení kyseliny arachidonové.14
Nevyužívání imunologických parametrů při diagnostice sepse
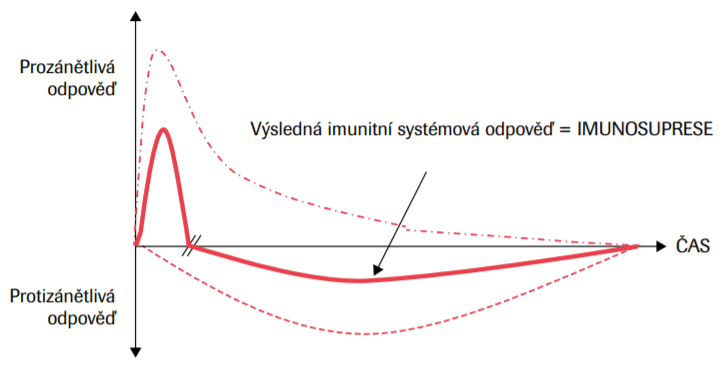
Je to paradox. Ačkoli je sepse definována jako nepřiměřená reakce imunitního systému na infekci, využití imunologických parametrů v klinické praxi je minimální. Přitom studie opakovaně prokázaly, že tyto parametry jsou důležité a užitečné jednak při stanovení diagnózy sepse, jednak pro prognózu pacienta.15 Dysfunkci imunitní odpovědi u sepse vidíme v čase, a to jak v humorální (protilátkové), tak buňkami zprostředkované imunitě.16,17 Výsledným funkčním stavem je imunosuprese (obr. 1). Laboratorní nálezy mohou být velmi různorodé. U části pacientů dochází k významně zvýšené protilátkové odpovědi v důsledku infekce, kde koncentrace imunoglobulinů v séru je vysoká. Naproti tomu u nezanedbatelného počtu pacientů detekujeme hypogamaglobulinemii, která je prediktivním faktorem nepříznivého klinického výsledku.
U těchto pacientů můžeme navíc využít cílenou substituční terapii intravenózními imunoglobuliny.18,19 Stanovení koncentrace imunoglobulinů v séru je velmi jednoduché a dostupné s obdržením výsledku v řádu desítek minut od odběru. Exprese CD64 na neutrofilech je velmi užitečným a specifickým parametrem pro stanovení diagnózy sepse,20,21 s využitím technologie průtokové cytometrie. Stanovení exprese HLA-DR na monocytech je parametrem tzv. imunoparalýzy a jeho význam pro prognózu pacienta byl opakovaně prokázán.22,23 Také zde můžeme v některých případech použít podpůrnou imunomodulační terapii.24,25 Limitem je používaná technologie průtokové cytometrie, která není dostupná pod dobu 24 hodin. Úspěšná a včasná diagnostika sepse má své konsekvence i v terapeutické části. Kromě již zmiňovaného příznivého vlivu včasného nasazení antibiotické terapie máme sice omezené, ale přece jen určité možnosti ovlivňující dysfunkci imunitního systému.26,27 Uplynulých 30 let sice vedlo k určité deziluzi stran imunomodulační terapie sepse, ale právě nové možnosti „omicsových“ technologií mají potenciál stratifikovat pacienty se sepsí podle jejich individuálně nastavených parametrů imunitní odpovědi k infekci, což povede k úspěšné imunomodulační terapii.28
Souhrn
Zlepšení diagnostiky sepse nám přinese i) využití proteomiky k detekci nových parametrů, které nejsme schopni měřit aktuálně používanými technologiemi, ii) využití hmotnostní spektrometrie k jejich kvantitativnímu stanovení. Důsledkem včasné a spolehlivé diagnostiky sepse bude racionální použití imunomodulační terapie. Rovněž v této oblasti je nezbytným předpokladem využití „omicsových“ technologií a aplikace personalizované medicíny.