V minulém čísle jsme se zabývali děním v kalifornské firmě Cetus Corporation v době, která předcházela objevu, jenž v následujících dekádách podstatně změnil průkaz patogenních mikrobů a tím i diagnostiku infekčních onemocnění a výrazně přispěl k objasnění řady patogenetických mechanismů. Vyprávění jsme ukončili poté, co Kary Mullis zformuloval koncepci PCR. Popsali jsme potíže s publikováním metody v prestižních vědeckých časopisech. Přinesli jsme i vyjádření paní Nancy Mullisové k důvěryhodnosti našich zdrojů, z nichž vycházíme i v tomto pokračování. Podotýkáme, že nikdo ani v nejmenším nezpochybňuje zásluhy objevitele PCR. Od objevu po uvedení koncepce do praxe v podobě konkrétních diagnostických souprav vedla však ještě dlouhá cesta, v níž hráli roli další protagonisté. Řadu z nich měl autor tu čest v devadesátých letech osobně poznat.
Cetus Corporation a PCR – příprava pro rutinní provoz
Po ověření správnosti koncepce PCR zbýval jediný, avšak zásadní problém, který ve svých důsledcích znemožňoval využití PCR v rutinních laboratořích. Všechny dosavadní experimenty s novou technologií byly prováděny s tzv. Klenowovým fragmentem, což jsou přibližně 2/3 molekuly POL I (DNA polymerázy) Escherichia coli. Fragment byl vybrán proto, že byl jednak komerčně dostupný, jednak byly Arthurem Kornbergem údajně velmi dobře popsány jeho vlastnosti. Jak se však později ukázalo, tento popis zdaleka nebyl přesný, dá se říci, že byl přímo chybný: E. coli má nejméně 3 polymerázy, z nichž POL I není zodpovědná za replikaci genomu, nýbrž plní funkci opravné (tzv. repair) polymerázy. To však nebyl hlavní důvod potíží. Enzym je tepelně inaktivovatelný a při teplotách nad 90 °C, při nichž probíhá denaturace dvouřetězcové DNA, je zničen. Bylo jej tedy nutno přidávat do reakční směsi před nasednutím primerů v každém cyklu, což bylo nejen zdlouhavé, ale představovalo to i možný zdroj kontaminace. Kary Mullis se snažil testovat i některé další enzymy, přičemž k porovnání měl Klenowův fragment jako zlatý standard.
Tom White a Jeff Price si tuto nevýhodu uvědomovali, a proto požádali o konzultaci předního odborníka v oboru enzymologie Davida Gelfanda. Ten plně podpořil Mullise v jeho snaze o změnu enzymu. Ukázalo se však, jak málo poznatků o enzymech bylo publikováno. Enzym s požadovanými parametry cca 65 °C pro annealing primerů a cca 95 °C pro denaturaci nikde popsán nebyl. Na světě se problematikou termofilních enzymů zabývaly pouze 2 skupiny vědců – jedna v Cincinnati a druhá v SSSR. Publikačně aktivnější byli Sověti, zveřejňující 1 článek ročně. Kritéria termostabilního enzymu pro PCR byla stanovena: aktivita v rozmezí 60–75 °C, stabilita do 95 °C. Pro odlehčení uvádím historku, kterou jsem slyšel v roce 1995, kdy jsme spolu s Pavlem Henčlem navštívili Roche Molecular Systems Inc. v kalifornské Alamedě, sídlící stále v bývalém areálu Cetus Corporation, o tom, jak Kary Mullis došel k nápadu s termostabilním enzymem. Bylo to v roce 1985, kdy se svou přítelkyní o dovolené navštívil Yellowstonský národní park a seznámil se s bakteriální flórou žijící v tamních horkých pramenech. Bylo evidentní, že pokud teplota vody tryskající z pramene Old Faithful je 96 °C, bakterie Thermus aquaticus zde žijící musí tuto teplotu vydržet. A protože se dále množí, musí její enzymy fungovat. Pracují však termostabilní polymerázy i při nižších teplotách? K odpovědi na tuto otázku bylo třeba enzym izolovat a purifikovat.
V Cetus Corporation existovalo enzymologické oddělení s pracovníky dostatečně kvalifikovanými pro tento úkol. Mullis však tvrdě narazil. Ředitel Fildes v té době ve snaze vyvinout nový protinádorový lék tvrdošíjně odmítal „plýtvat zdroji a kapacitami na neterapeutické projekty“ (odmítavý názor na PCR změnil teprve v roce 1990), navíc Mullisovy vztahy se spolupracovníky nebyly zrovna nejlepší. Rozhodně nebyly tak dobré, aby kvůli němu někdo riskoval roztržku s ředitelem.
Vznětlivý Mullis se, lidově řečeno, šprajcl a purifikaci enzymu vlastníma rukama odmítl. Tom White věděl, že potřebnou kvalifikaci i schopnosti k tomu Kary má. Mohl mu to tedy nařídit. Mullis následně dostal nabídku od Davida Gelfanda, který mu dal k dispozici svou laboratoř. Mullis ji však nevyužil. Skupina ztratila trpělivost
a purifikace se ujali David Gelfand a Susanne Stoffel, Švýcarka se zkušenostmi z purifikace enzymů, pracující v Cetus Corporation od roku 1978. Během 3 týdnů převážně přesčasové práce izolovali polymerázy ze všech kmenů termofilních bakterií získaných z American Type Culture Collection. K purifikaci a testování posledního enzymu, shodou okolností Taq (bakterie Thermus aquaticus), byl údajně pozván i Mullis. Ten tvrdí, že pozván nebyl, nicméně jím poslaný Fred Faloona přítomen byl a odnesl do Mullisovy laboratoře polovinu množství purifikovaného enzymu. Během následujícího dne se při sérii provedených pokusů s Mullisem přesvědčili, že PCR s termostabilním enzymem Taq funguje podle jejich představ.
Překvapením pro všechny byla nejen výrazně vyšší specificita reakce ve srovnání s Klenowovým fragmentem, což se dalo předpokládat, nýbrž i minimálně o dva řády vyšší senzitivita. David Gelfand to komentoval slovy: „Neměli jsme ani tušení, jak je Klenowův fragment špatný, neboť byl výrazně lepší než cokoli používané předtím.“
Koncepce PCR byla vytvořena, v laboratorních podmínkách bylo ověřeno, že funguje, první výsledky byly konečně připraveny k publikaci, žádosti o patentovou ochranu podány, stále si však v Cetus Corporation nemohli říci, že je hotovo.
Odchod Karyho Mullise z Cetus Corporation

Znechucený, zklamaný a zahořklý Kary Mullis odmítá jakoukoli odpovědnost za dosavadní publikační debakl. Je nesmírně rozhořčen, cítí se zneuznán a okraden. A to i přesto, že mu již na jaře 1986 nechal Tom White vyplatit zvláštní cílovou odměnu 10 000 USD, nejvyšší v historii firmy, což bylo velmi neobvyklé. Po příchodu Petera Fildese byl totiž bonusový program pro vědecké pracovníky Cetus Corporation zrušen. Dostávali jen symbolický 1 dolar za přijatý patent. To se týkalo i následných odměn všech ostatních pracovníků PCR skupiny. Hromosvodem Mullisova hněvu byli Tom White a Norman Arnheim. Nakonec se dohodli na Mullisově odchodu z firmy v září 1986 za následujících podmínek: vyplacení pětinásobku měsíčního příjmu a uvedení K. Mullise jako prvního autora u všech publikací o PCR v následujících pěti letech.
Máme PCR, ale co teď s tím?
Cetus Corporation pod vedením Petera Fildese měla stejně jako konkurenční biotechnologické firmy ambici uplatnit se v oblasti vývoje a výroby moderních léčiv. Se zaměřením na oblast diagnostiky se stále ještě značná část pracovníků, včetně vedoucích, teprve smiřovala. Mnozí vzpomínali na první dekádu činnosti Cetus Corporation, charakteristickou tvůrčí svobodou vědeckých pracovníků a flexibilitou výrobního programu. Druhou stránkou tohoto vývoje byly souboje o každé strategické rozhodnutí. Také synchronizace probíhajících projektů značně pokulhávala a tento stav znemožňoval interdisciplinární přístup k řešení. I přes veškerou snahu Petera Fildese bylo jasné, že přišel čas na reorganizaci společnosti, neboť jisté turbulence a konflikty mezi vedoucími pracovníky ve firmě, provázené nabídkami rezignace, neunikly pozornosti akcionářů, což mohlo vyústit ve zvýšenou ekonomickou vulnerabilitu firmy. Proto nakonec dochází k dohodě. Ředitelkou programu klinických zkoušek byla jmenována Judy Blackmore, zatímco Research and Diagnostics byla nadále řízena samostatně. Písemná dohoda uzavřená na 3 roky s platností od 1. 6. 1987 navíc zaručovala vedoucím vědeckým pracovníkům v případě odchodu kompenzaci ve výši ročního platu.
Práva společnosti na PCR byla zpochybňována v soudním sporu s firmou DuPont. Pomalu se rozvíjel program spolupráce s firmou Kodak dle smlouvy z února 1986 na vývoji in vitro diagnostických testů. Se společností Perkin-Elmer vytvořil Cetus v prosinci 1985 joint venture (společné podnikání) s názvem PECI (Perkin-Elmer Cetus Instruments), výsledkem této spolupráce byl první automatický termocyklér, jehož vývoj byl dokončen v listopadu 1987. Termocyklér značně snížil pracnost provádění PCR v laboratoři. Bohužel se objevily nové problémy v podobě falešně pozitivních výsledků, které postupně přibývaly s každým následujícím experimentem. Příčinou byla kontaminace laboratoře aerosolem obsahujícím DNA, vznikajícím při pipetování automatickými mikropipetami, o čemž neměl v té době nikdo ani tušení. Shodné problémy se objevily ve vědeckých institucích, které se rozhodly aplikovat PCR ve svých laboratořích. Patentová ochrana (první patenty byly přiznány v roce 1987) se vztahovala na komerční využití technologie a akademické instituce.
V lednu 1988 se Tom White rozhodl rezignovat na svou funkci a odejít zpět na univerzitu v Berkeley, kde strávil celý rok vývojem techniky PCR pro molekulárně biologické studie v evoluční biologii hub a plísní. Je autorem primerů ITS1–ITS5 (internal transcribed spacer region) a NS6–NS8 (nuclear small subunit rDNA). Viz White TJ, Bruns T, Lee S, Taylor J (1990): Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols: a guide to methods and applications. (Innis MA, Gelfand DH, Sninsky JJ, White TJ, eds). Academic Press, New York, USA: 315–322. V létě 1988 začínají vrcholní manažeři Cetus Corporation konečně připravovat obchodní strategii pro PCR. V listopadu je založena nová divize firmy – PCR, v jejímž čele stojí obchodní ředitelka Ellen Daniell a ředitel výzkumu John Sninsky. Oponenti tohoto řešení uvnitř firmy kritizují vznik dalších manažerských pozic a vyslovují (celkem správně) obavy, že v brzké době dojde k prodeji celé divize PCR strategickému partnerovi. K tomuto názoru je vede i probíhající ofenziva v oblasti Public Relations, zaměřená na PCR.
Prvním z velkých hráčů na globálním diagnostickém trhu, kteří projevili zájem o nabízející se potenciál PCR, byla společnost Kodak. Nicméně předmětem tříleté dohody o spolupráci s Cetus Corporation byl vývoj rychlých imunodiagnostických testů do ordinace lékaře (Point of Care Tests). Navzdory této skutečnosti se Kodak podílel na podpoře vývoje některých produktů v oblasti PCR diagnostiky, zejména testů HIV a HLA. Řada dalších velkých společností (např. DuPont, Johnson&Johnson, Abbott a další) se zajímala o možné budoucí aplikace a licenční podmínky technologie PCR. S blížícím se koncem platnosti smlouvy o spolupráci s Kodakem si manažeři Cetus Corporation představovali zvýšený zájem protistrany na podpoře výzkumu a vývoje. Vedl je k tomu pokrok ve výzkumném programu IL-2 (interleukin 2), který se v roce 1988 nacházel ve finální fázi klinických studií.
Ve stejné době se na scéně objevuje nový partner pro jednání: švýcarský koncern F. Hoffmann-La Roche. A není to partner ledajaký. Mimo jiné vlastní exkluzivní práva k základnímu Tanigučiho patentu týkajícímu se rekombinantního IL-2, která před časem získal od japonské společnosti Ajinomoto. Cetus Corporation vyvinul vlastní mutein interleukinu IL-2 (mutein = protein se změněnou sekvencí aminokyselin) chráněný americkým patentem, který žadatele dosáhnuvšího výsledku na území USA upřednostňuje před zahraničními konkurenty a poskytuje práva na komerční využití v USA. Mimo USA je však plně respektována časová priorita a tu měl evidentně Taniguči, který dosáhl výsledků v Tokiu na Japan Cancer Research Foundation, a podlicenci s právy na komerční využití pak získala firma Ajinomoto. Nový vlastník podlicenčních práv, společnost F. Hoffmann-La Roche, sice nemohl zabránit Cetusu Corporation v obchodním využití IL-2 v USA, avšak zcela jistě ano v Japonsku a v Evropě. To by samozřejmě značně zkomplikovalo návratnost společného projektu, do něhož kromě Cetus Corporation investoval miliardy dolarů i Kodak. Přestože vůle obou jednajících stran byla totožná – výměna podlicence IL-2 za licenci na PCR, jednání byla složitá a tvrdá. Ve společnosti F. Hoffmann-La Roche samozřejmě věděli, že Cetus Corporation má za sebou řadu soudních sporů, některé dosud neuzavřené, se svým konkurentem Amgen, kde vyvinuli rovněž rekombinantní IL-2 (další mutein).
V právně nejasné situaci byl úspěšnější Cetus Corporation, jenž získal právo dodávat IL-2 pro probíhající klinické studie. Peter Fildes a Jeff Price si plně uvědomovali zátěž, jakou znamenají vleklé soudní spory (viz Cetus Corporation–DuPont) i skutečnost, že F. Hoffmann-La Roche není Amgen, takže v případném soudním sporu by šance Cetus Corporation na úspěch byly zřejmě mizivé. Šlo tedy hlavně o to, nakolik si každá ze stran jednání cení PCR. V F. Hoffmann-La Roche velmi dobře chápali význam a budoucí potenciál PCR. Proto cena nehrála hlavní roli. Podmínkou ovšem byl dvoucestný kontrakt – pouze Cetus a Roche, nikdo další. Na základě první podepsané dohody z roku 1989 se F. Hofmann-La Roche zavázal investovat do výzkumu Cetus Corporation 6 milionů dolarů ročně po dobu pěti let a vyplatit patřičné odškodné ostatním účastníkům joint venture projektů a poskytovatelům služeb. Společnost F. Hoffmann-La Roche zároveň nakoupila milion akcií Cetus po 15 dolarech za kus (dle Wall Street Journal o 3 $ nad aktuální burzovní cenou). Druhá dohoda se týkala IL-2. Cetus byl vyvázán z omezení patentem vlastněným F. Hoffmann-La Roche a obě společnosti se zavázaly sdílet klinická data.
Zároveň s blížícím se podpisem dohod byl Jeff Price požádán o doporučení pracovníka, který by byl vhodným vedoucím programu PCR, pokud by společnost F. Hoffmann-La Roche k němu získala práva. Price doporučil Toma Whitea. White byl osloven v lednu 1989, měsíc po vypršení smlouvy Cetus Corporation–Kodak. Nyní se čekalo na konečné rozhodnutí soudu v patentovém sporu Cetus Corporation–DuPont. Mezitím, jako důsledek Fildesova agresivního stylu vedení společnosti a druhé dohody Cetus Corporation–Roche, odchází z divize Research and Diagnostics řada vědeckých pracovníků a stupňuje se problém s jejich adekvátní náhradou. V létě 1990 dochází k dalšímu otevřenému konfliktu mezi Fildesem a vědeckými pracovníky R&D. David Gelfand proto organizuje schůzku s Ronem Capeem, kde upozorňuje na skutečnost, že pod Fildesovým vedením nedochází k reorganizaci, nýbrž k likvidaci firmy. Gelfand si s hořkostí uvědomuje, že k současnému stavu přispěla rovněž pasivita Rona Capea a naprosté ignorování připomínek vědeckých pracovníků R&D.
16. srpna 1990 dvaapadesátiletý Peter Fildes rezignuje na svou funkci prezidenta a CEO Cetus Corporation. Osudným se mu stalo odmítnutí schválení IL-2 jako protinádorového léku FDA (Food and Drug Administration). Oficiálně pro nedostatečnou průkaznost klinických studií, jež je potřeba přepracovat. Nové vedení ve složení Ron Cape a Hollings Renton musí řešit nejen situaci se ztrátou 120 milionů dolarů investovaných do vývoje IL-2, nýbrž i problémy se zuřícími akcionáři, podnikajícími příslušné právní kroky. Společnost čeká redukce počtu pracovníků z 950 na 100.
Příznivá zpráva přichází teprve 28. února 1991: Soud jednomyslně přiznal platnost patentové ochrany technologie PCR firmy Cetus Corporation, a to ve všech 50 bodech. Tím skončil vleklý právní spor Cetus Corporation–DuPont. Zároveň padla poslední překážka bránící odkoupení projektu PCR společností F. Hoffmann-La Roche. 23. července 1991 dochází k tajné dohodě mezi Cetus Corporation a Chiron Inc., v níž se Chiron zavazuje koupit balík akcií Cetus za 660 milionů dolarů. V blízké budoucnosti za ně má získat přibližně 330 milionů dolarů z prodeje PCR a zbytek v hotovosti, pohledávkách a zařízení. 12. prosince 1991 F. Hoffmann-La Roche finalizuje dohodu s Cetus Corporation a kupuje technologii PCR za 300 milionů dolarů. Zároveň Chiron veřejně oznamuje akvizici zbytku Cetus Corporation. Obě zprávy plní stránky následujícího vydání The Wall Street Journal.
Je 300 milionů dolarů adekvátní cena? Jako v každém obchodě i zde platí, že prodejní cena může být stanovena pouze v takové výši, jakou je ochoten kupující zaplatit. Představy Petera Fildese byly o 50 milionů vyšší. Půl roku před uzavřením dohody byla předpokládaná cena 330 milionů. Podle první dohody však firma F. Hoffmann-La Roche již investovala 15 milionů do akcií, dalších 15 milionů do pokračujícího vývoje technologie PCR a jistou, patrně nemalou, nezveřejněnou částku v rámci odškodnění předchozích smluvních investorů. I tyto skutečnosti hrály roli při stanovení konečné prodejní ceny, za niž se společnost F. Hoffmann-La Roche stala držitelem všech dosud udělených patentů týkajících se PCR a získala práva na jejich komerční využití.
Svěží vítr pod křídly Roche

Dosazení Toma Whitea na pozici ředitele projektu PCR F. Hoffmann-La Roche byl velmi dobrý tah. Umožnil totiž udržení kontinuity vývoje technologie v rámci projektu a plynulou přípravu obchodně využitelných diagnostických souprav. I přes výše zmíněný odliv pracovníků z R&D postavy klíčové pro PCR diagnostiku díky Whiteovi zůstávají a připravují první soupravy k uvedení na trh. Nejrozpracovanější byly testy HLA a HIV-1, pracující se vzorky plné krve. Hledají se další vhodná agens, u nichž je klasická diagnostika obtížná. A zde jsou na prvním místě chlamydie. Hledá se rovněž obchodní značka pro testy: po zvážení řady různých návrhů vítězí AMPLICOR. Důvody – jedná se o amplifikaci in vitro, amplifikují se úseky DNA z jádra buněk, a použijeme-li odlišnou transkripci názvu amPliCoR, je v něm obsažena zkratka PCR.
Důležitým požadavkem bylo, aby testy AMPLICOR byly uživatelsky příjemné, nevyžadovaly pořízení drahého instrumentária, nebyly příliš pracné a daly se stihnout v průběhu jedné pracovní směny. Proto slavná fenol-chloroformová extrakce DNA nepřicházela v úvahu. Byla zvolena precipitační metoda s centrifugační separací – zde se vycházelo z evropského vybavení pro laboratoře. Používala se mikrocentrifuga Eppendorf s kónickými mikrozkumavkami Eppendorf 2 ml se šroubovacím víčkem. Termocyklér byl zajištěn jednáním s firmou Perkin-Elmer. Šlo o typ TC 9600 s dutou hliníkovou cyklační komorou pro 96 amplifikačních mikrozkumavek 200 l, v níž proudil olej měnící teplotu. Víko cyklační komory bylo elektricky vyhřívané, aby se zabránilo tvorbě kondenzátu na víčku amplifikačních zkumavek. Tento přístroj byl jedinou nutnou investicí do přístrojového vybavení laboratoře. I když nemusel být. Pamatuji si, jak jsem při návštěvě vědeckého pracoviště v Rusku někdy koncem roku 1994 viděl náhradu v podobě tří vodních lázní s konstantní teplotou a stopkami.
Obsluha byla dvoučlenná. Jeden pracovník hlídal inkubační doby na stopkách a dával pokyny druhému, který přemisťoval stojánek s amplifikačními zkumavkami mezi jednotlivými vodními lázněmi. Výsledky měli překvapivě dobré. Nespornou výhodou testů AMPLICOR byla detekce. Žádná agarózová elektroforéza. Systém AMPLICOR pracoval se značenými primery, na jejichž 5´ konci byl navázán biotin. K detekci se užívala polystyrénová mikrotitrační destička s jamkami typu P (s plochým dnem), v nichž byl navázán streptavidinový konjugát s křenovou peroxidázou, který vychytával biotinylované amplikony a fixoval je na destičce. Po následném energickém promytí byl přidán substrát tetramethylbenzidin. Ten působením křenové peroxidázy změní barvu na modrou, reakce se zastaví dvacetiprocentní kyselinou sírovou. Změna pH rovněž změní barvu z modré na žlutou, odečítanou při 450 nm. Promývačky mikrodestiček i optické denzitometry patřily k běžnému vybavení laboratoří. ELISA byla v té době používána v rutinní diagnostice zcela běžně, stejně jako termostaty a automatické mikropipety. K nutnému vybavení patřily ještě vysokofrekvenční vibrační třepačky (tzv. vortex), jež však představovaly minimální investici. Doporučený byl i kontaktní inkubátor typu dry-block pro zajištění lýzy tkání při přípravě vzorku.
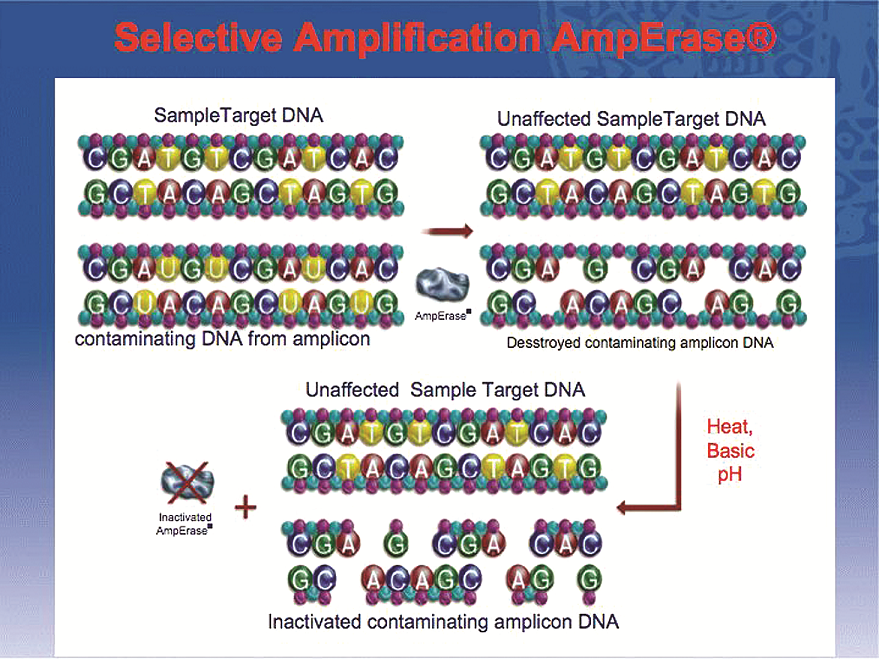
Poslední problém, který bylo třeba vyřešit před uvedením testů AMPLICOR na trh, bylo zábránění tzv. cross-over kontaminaci vzorků amplikony z prostředí laboratoře, přinášející falešně pozitivní výsledky. Stalo se tak systémem AmpErase™, který byl předmětem dalšího patentu. Využívá se zde komplementarity bází adenin–uracil. Při syntéze nových amplikonů se místo deoxythimidinu zabudovává do DNA deoxyuridin. Amplifikovaná DNA se tedy liší od DNA přírodní. Není třeba se starat, zda dojde ke kontaminaci reagenční směsi se vzorkem před amplifikací z prostředí laboratoře. V tzv. MasterMixu je obsažen enzym uracil-N-glykosyláza. Při preinkubační teplotě do 60 °C má tento enzym 5 minut na to, aby přerušil páteřní vazbu deoxyuridinu se sousedními nukleotidy. Ty jsou nadále fixovány pouze dvojicí H-můstků. Následuje-li denaturace dvouřetězcové DNA, jsou uvolněny zcela. Kontaminující DNA je navíc rozpadlá na fragmenty, které nemohou sloužit jako matrix pro následnou amplifikaci, zatímco řetězce přírodní DNA ze vzorku zůstaly kompletní a nepoškozené. Nyní zbývá jediné, inaktivace uracil-N-glykosylázy, což se děje zahřátím směsi na 95 °C po dobu 5 minut.
Nabízí se otázka: Proč takový spěch s uvedením testů na trh? V této souvislosti je třeba si uvědomit, že část základních patentů k PCR byla přiznána již v roce 1988, takže v době definitivního uzavření kontraktu byly již téměř 4 roky z desetiletého období patentové ochrany pryč. I když se předpokládalo využití možnosti prodloužení patentové ochrany o dalších 10 let, nešlo z tehdejšího pohledu o exkluzivitu nijak zvlášť dlouhodobou. Musíme vzít v úvahu i stav tehdejšího technického rozvoje, zejména v oblasti informační techniky. Byly k dispozici první osobní počítače s RAM 64 kB, nejrychlejší procesor 386 Hz, pomalé jehličkové tiskárny s traktorovým posunem papíru, objemné monitory se zelenobílou obrazovkou, často padající sítě s pomalým přenosem a první, tehdy ještě analogové mobilní telefony, svou robustností spíš vhodné k zatloukání hřebíků. Vrcholem rychlosti v přenosu informací byl fax. Prezentace jsme připravovali pořízením sady diapozitivů na klasický inverzní filmový materiál vyvolávaný mokrou cestou. Diapozitivy se pak promítaly klasickým optickým projektorem na plátno a doprovázely mluveným slovem. Pokud byl potřeba pohyblivý obraz, nezbylo než natočit film dle předloženého scénáře nebo videozáznam na magnetickou kazetu, zde však byl poměrně velký výběr vzájemně nekompatibilních systémů. Akcelerace vývoje technologií nás teprve čekala. Ale o tom až příště…