Historie a původ viru
Virus Zika byl poprvé izolován z krve makaka v roce 1947 při výzkumu viru žluté zimnice v ugandském pralese s názvem Zika, který se rozkládá na břehu Viktoriina jezera nedaleko hlavního města Kampaly1,2. V místním jazyce, gandštině, slovo zika znamená „zarostlý“. Odtud nově objevený virus získal své jméno. V roce 1952 byl virus poprvé potvrzen u lidí v Ugandě a Tanzanii a od této doby byly zaznamenány sporadické humánní infekce na různých místech Afriky a Asie3. Protože virus způsoboval pouze nezávažné samoúzdravné horečnaté onemocnění, nebyl mu připisován větší význam a zůstával dlouhá léta stranou zájmu lékařů, vědců i veřejnosti.
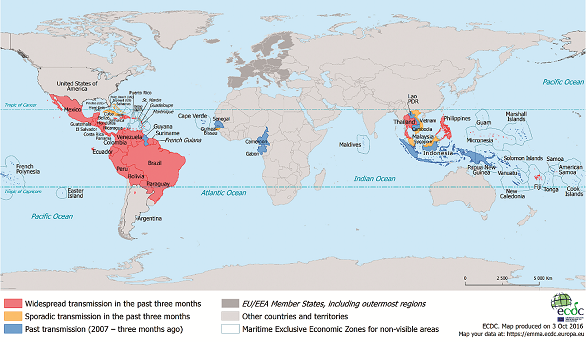
První větší hromadný výskyt infekce virem Zika byl zaznamenán v roce 2007 na ostrově Yap v Mikronésii, kde se tímto virem nakazilo okolo 70 % obyvatelstva, což představuje přibližně 5 000 nakažených při celkové populaci ostrova čítající 6 700 osob4. Další epidemie se vyskytla v letech 2013–2014 ve Francouzské Polynésii, kdy se nakazilo přibližně 60 % populace, tedy přes 30 000 osob. Jednalo se zde o rozsáhlejší populaci než na ostrově Yap a bylo zpětně prokázáno, že v souvislosti s touto epidemií se zde narodilo více novorozenců s mikrocefalií, než bylo obvyklé v předchozích letech5. Na západní polokouli se virus rozšířil v roce 2014, kdy byl nalezen nejprve na Velikonočním ostrově6. V květnu 2015 byl poprvé detekován v Brazílii, ovšem předpokládá se, že ve skutečnosti zde byl přítomen již na přelomu let 2013–2014 7. V následujícím období se virus masivně rozšířil do celé Latinské Ameriky a Karibiku. V roce 2014 se rozšířil také do Nové Kaledonie a na další tichomořské ostrovy a v r. 2016 na Kapverdské ostrovy8,9. Během roku 2016 se virus objevil i v jihovýchodní Asii. V červenci 2016 byly zaznamenány první případy autochtonních nákaz v USA na Floridě10. Aktuální údaje o rozšíření viru Zika ve světě včetně mapy výskytu jsou umístěny na webu ECDC (European Center for Disease Control), tato data jsou pravidelně aktualizována, viz obr. 1.
Virus Zika vyvolal významnější zájem až v roce 2015 z důvodu podezření na teratogenní účinky tohoto viru. V Brazílii byl v souvislosti s rozsáhlou epidemií viru Zika zaznamenán neobvykle vysoký počet novorozenců postižených vrozenými vývojovými vadami mozku spojenými s mikrocefalií. Takto postižené děti se rodily matkám, které v těhotenství prodělaly nákazu virem Zika. Následně byla tato souvislost jednoznačně prokázána a z toho důvodu je dnes virus Zika řazen do skupiny agens označované akronymem TORCH, zahrnující infekce s teratogenním účinkem na plod při infekci v těhotenství. Tradičně sem patří toxoplazmóza, rubeola, cytomegalovirus, herpes simplex virus a varicella-zoster virus.
Základní charakteristika viru Zika
Virus Zika patří do čeledi Flaviviridae, rodu Flavivirus. Jedná se o obalený středně velký RNA virus, viz obr. 2. Virová RNA je nesegmentovaná a stejně jako u ostatních flavivirů kóduje celkem 10 proteinů, z nichž 3 jsou strukturální (povrchový protein E, matrixový M a kapsidový C) a 7 je nestrukturálních (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5), které jsou exprimovány v různých fázích replikace viru. Virus je blízce příbuzný dalším flavivirům, mezi něž patří např. virus klíšťové encefalitidy, žluté zimnice, dengue, západonilské horečky nebo japonské encefalitidy. Stejně jako ostatní jmenované flaviviry se virus Zika způsobem přenosu řadí mezi arboviry, tedy viry přenášené členovci. Zika patří mezi velkou skupinu komářích arbovirů, jeho přenašečem jsou komáři rodu Aedes, především tropický druh Aedes aegypti. V laboratorních podmínkách bylo prokázáno, že rovněž komár Aedes albopictus, invazivní druh tolerující i nižší teploty, je schopen přenášet virus Zika. Virus Zika byl nalezen i u dalších druhů komárů rodu Aedes, Anopheles, Culex a Mansonia11.
Na základě drobných genetických odlišností se rozlišují 2 linie viru Zika – linie africká a asijská, které se liší teritoriem výskytu a pravděpodobně i svou virulencí. Africká linie byla prozatím nalezena pouze v Africe a nezdá se, že by docházelo k jejímu šíření mimo původní kontinent. Virus, který je nyní rozšířen v Latinské Americe, je asijskou linií viru; k jeho rozšíření do Ameriky došlo pravděpodobně z východního Pacifiku, kde je tato linie přítomna rovněž, stejně jako na endemických územích Asie a na Kapverdských ostrovech. Je pravděpodobné, že právě asijská linie viru je více virulentní než linie africká a má také větší potenciál, pokud jde o intrauterinní infekci plodu s následným vývojovým postižením12.
Klinický obraz
Inkubační doba od okamžiku bodnutí nakaženého komára se pohybuje v rozmezí 3–12 dní. Jen ve 20–25 % probíhá nákaza symptomaticky. Klinické příznaky trvají obvykle 4–7 dní 13. Virémie koreluje s obdobím klinických příznaků, ale virus může být přítomen v krvi až 10 dní před nástupem symptomů14. V případě asymptomatického průběhu je rovněž po dobu několika dní přítomna virémie. Typickými příznaky horečky Zika jsou náhlý vzestup teploty (zpravidla do 38,5 °C), makulopapulózní svědivá vyrážka, únava, myalgie, artralgie, retroorbitální bolest a konjunktivitida, někteří nemocní trpí rovněž gastrointestinálními příznaky – nevolností, zvracením nebo průjmem. Všechny uvedené příznaky odezní spontánně bez léčby zpravidla do 7 dní bez jakýchkoliv následků13.
U některých osob je infekce virem Zika komplikována závažným neurologickým syndromem Guillain Barré (GBS), který se projevuje těžkými chabými parézami. V případě postižení dýchacích svalů může končit smrtelně. Parézy jsou většinou reverzibilní, avšak u některých osob zůstávají reziduální parézy dlouhodobě. Jedná se o akutní zánětlivou demyelinizační polyneuropatii na podkladě autoimunitní reakce, kterou spouští probíhající infekce. Toto onemocnění vyvolávají různá infekční agens, nejen virus Zika, nicméně v oblastech s epidemickým výskytem viru Zika byl zaznamenán statisticky významný vzestup počtu případů GBS. U osob s infekcí virem Zika je riziko neurologických komplikací udáváno v rozsahu 1:5 000 (ve Francouzské Polynésii)15 nebo až 1:100 (v USA)16.
Kongenitální infekce Zika
Největší obavy vzbuzuje virus Zika v případě infekce vnímavých těhotných žen, u kterých intrauterinní infekce vyvolává zvýšené riziko kongenitálních malformací, a to i v případě, že u těhotné probíhá asymptomaticky. Bylo zjištěno, že virémie je u těhotných žen významně delší než u netěhotných, virová RNA v krvi těhotné byla prokázána až 53 dní, zatímco u netěhotných osob trvá maximálně 7 dní17. Příčina protrahované virémie u těhotných ani její význam pro závažnost intrauterinní infekce nejsou zatím jednoznačně objasněny. Riziko vzniku kongenitálních malformací u plodů žen nakažených virem Zika v těhotenství se odhaduje až na 29 %, přičemž bylo prokázáno, že riziko pro plod existuje při nákaze matky v kterémkoliv trimestru gravidity18,19. Příčinou poškození vyvíjejícího se mozku je jak přímý cytopatický účinek viru, tak pravděpodobně i imunitní reakce na infekci, která se uplatňuje v pozdějších fázích gravidity. Typickými projevy kongenitální infekce virem Zika jsou mikrocefalie, ventrikulomegalie, hypoplazie thalamů, mozečku, mozkového kmene, ageneze corpus calosum, kalcifikace kortikosubkortikální a v bazálních gangliích, poruchy gyrifikace mozku, chorioretinitida, hypoplazie očního nervu, katarakta a arthrogrypóza. Byly popsány rovněž malformace srdce, zažívacího traktu a genitouretrálního traktu20.
Způsob přenosu
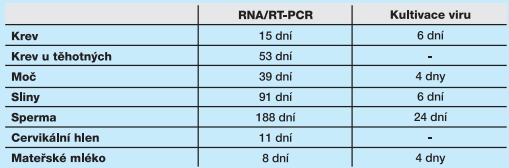
Dominantně se virus Zika přenáší na člověka prostřednictvím štípnutí infikovaného komára rodu Aedes, podobně jako je tomu u řady dalších arbovirových nákaz přenášených komáry (např. dengue, chikungunya nebo žlutá zimnice). Na rozdíl od nich se však virus Zika může šířit i pohlavním stykem, řadí se tedy nově také mezi sexuálně přenosné choroby (STD). Sexuální přenos byl prokázán nejen z muže na ženu, ale i z ženy na muže a také při homosexuálním styku mezi dvěma muži. K nákaze může dojít při vaginálním, análním i orálním sexu. Zdrojem infekce může být člověk se symptomatickým i asymptomatickým průběhem nákazy. Epidemiologicky významnou skutečností je dlouhá doba vylučování viru spermatem a vysoká virová nálož, která byla ve spermatu zjištěna až 100 000x vyšší než v krvi21. Infekční virus byl ze spermatu izolován po 24 dnech, virová RNA až 188 dní22. Ačkoliv přítomnost viru byla prokázána i v dalších tělesných tekutinách po různě dlouhou dobu, viz tab. 1, přenos nákazy byl potvrzen zatím pouze prostřednictvím spermatu, cervikálního hlenu nebo krve při krevní transfuzi.
Metody laboratorní diagnostiky
V diagnostice nákaz virem Zika se využívají metody přímé i nepřímé, přičemž každá z nich má své výhody i limity a z toho plynoucí uplatnění.
Přímý průkaz: RT-PCR
K přímému průkazu virové RNA se používá metoda RT-PCR. Jedná se o metodu s vysokou citlivostí i specificitou. Toto vyšetření se provádí z plazmy, séra, moči nebo spermatu, v odůvodněných případech lze vyšetřit i jiné vzorky (např. likvor, sliny, plodovou vodu nebo sekční materiál). Krev je vhodným materiálem k vyšetření metodou RT-PCR pouze v prvních dnech onemocnění, maximálně do 7. dne, protože po této době již většinou virémie není přítomna. V moči bývá virus přítomen o něco déle, proto je moč vhodným materiálem k vyšetření po dobu až 14 dní od nástupu příznaků. Sperma vyšetřujeme pouze u mužů, kterým byla infekce virem Zika potvrzena jinou metodou, např. pozitivitou RT-PCR v krvi nebo v moči nebo průkazem specifických protilátek. Avšak ani jediné vyšetření spermatu s negativním výsledkem nezaručuje nulovou pravděpodobnost přenosu viru pohlavním stykem, protože nelze vyloučit intermitentní vylučování viru do ejakulátu. Vhodnější je proto opakované vyšetření spermatu. U asymptomatických osob nemá vyšetření metodou RT-PCR žádné opodstatnění, protože pravděpodobnost správného načasování odběru vzorku na přímý průkaz při nepřítomnosti příznaků je mizivá.
V odborné literatuře lze nalézt popis celé řady metodik průkazu RNA viru Zika metodou PCR, nicméně ne všechny jsou ověřeny také pro asijskou linii viru Zika [30–33]. Dalším možným přístupem je amplifikace univerzální sekvence NS5 genu společné pro širokou skupinu flavivirů a následná sekvenační identifikace konkrétního druhu viru 34, kterou jsme využívali zvláště v počátcích epidemie, kdy nebyla dostupná jiná komerční diagnostika. V současné době je na trhu již k dispozici celá řada souprav pro průkaz RNA Zika viru metodou real-time RT-PCR. Centrum pro kontrolu nemocí a prevenci (CDC, Atlanta, USA) poskytuje Trioplex Real-time RT-PCR Assay, detekující současně kromě Zika viru také virus horečky dengue a chikungunya, které se vyskytují ve stejných oblastech jako virus Zika.
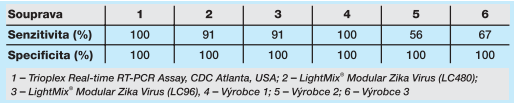
Vzhledem ke krátké a v čase klesající virémii je pro maximalizaci přínosu této diagnostiky důležitá dostačující citlivost těchto souprav. V období 2–10/2016 jsme mohli pracovat s 6 různými systémy pro detekci RNA viru Zika s následujícími zkušenostmi (porovnání souboru o 20–25 vzorcích). Jako referenční hodnoty byly použity výsledky získané v rámci rutinního testování na přítomnost RNA viru Zika soupravou „Výrobce 1“. Přestože testovaný soubor vzorků nebyl příliš rozsáhlý, bylo zřejmé, že systémy 5 a 6 nejsou dostatečně citlivé a nezachytí velmi nízké koncentrace viru (0 ze 4, resp. 1 ze 4, vzorky s Ct > 36), které jsou v rutinní diagnostice velmi časté. LightMix® Modular Zika Virus poskytoval výborné a dostatečně citlivé výsledky jak s použitím systému LC480, pro který je tento test určen výrobcem, tak se systémem LC96. V obou případech byly zachyceny 3 ze 4 velmi slabě pozitivních vzorků, a to i přesto, že byly před analýzou delší dobu skladovány (-80 °C), a nelze tedy vyloučit jejich částečnou degradaci. V rámci testovaného souboru byly zařazeny také vzorky obsahující RNA viru horečky dengue a chikungunya. V žádné testované komerční soupravě nebyla zjištěna zkřížená reaktivita mezi těmito viry.
Nepřímý průkaz: sérologie
Protilátky třídy IgM se objevují nejdříve 3. den od nástupu příznaků a vymizí do 3 měsíců. Protilátky třídy IgG nastupují o 1–2 dny později než IgM, ale přetrvávají dlouhodobě, snad i celoživotně, jako je tomu u jiných flavivirových infekcí. Pro stanovení specifických protilátek ve třídě IgG a IgM se využívá metoda ELISA nebo nepřímá imunofluorescence (NIF). Výhodou těchto metod je rychlost provedení, bezpečnost, možnost automatizace, standardizace a rozlišení jednotlivých tříd protilátek. Jako antigen se v těchto metodách využívá buď nativní antigen, rekombinantní E protein, nebo nestrukturální NS-1 antigen, někteří výrobci různé antigeny kombinují. Soupravy NIF a ELISA založené na nativním antigenu nebo E proteinu se vyznačují vysokou citlivostí, ale vykazují vysokou míru zkřížených reakcí s jinými flaviviry (např. dengue, žlutá zimnice nebo klíšťová encefalitida), a to především ve třídě IgG. Séra osob očkovaných proti některému z flavivirů nebo po prodělání flavivirové infekce reagují v těchto testech často falešně pozitivně. ELISA soupravy založené na NS-1 antigenu mají výrazně zredukovanou zkříženou reaktivitu s jinými flaviviry, ovšem za cenu nižší citlivosti těchto souprav. Při infekci reaguje imunitní systém tvorbou protilátek namířených proti strukturálním i nestrukturálním antigenům, ale protilátek proti strukturálním antigenům a zejména proti epitopům E proteinu se tvoří několikanásobně více než proti nestrukturálnímu antigenu NS-1. Z toho důvodu jsou soupravy s NS-1 antigenem méně citlivé než ty obsahující nativní antigen nebo E protein35.
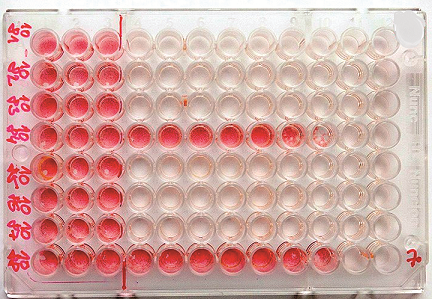
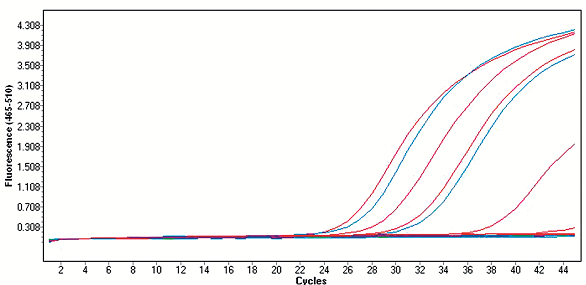
Z uvedených důvodů je pro co nejpřesnější výsledky nutno provést u všech vzorků i konfirmační vyšetření virusneutralizačním testem (VNT), který je nejspecifičtější a současně velmi citlivou sérologickou metodou. Pomocí VNT se stanovují neutralizační protilátky, nelze jím však rozlišit jednotlivé třídy protilátek. Akutní infekci lze prokázat pouze pomocí párových sér nebo kombinací VNT s jinou sérologickou metodou, která dokáže určit jednotlivé třídy protilátek. Nevýhodou VNT je jeho zdlouhavost (celý test trvá 5–7 dní) a nutnost práce s infekčním virem a buněčnými kulturami, test je proto vyhrazen pouze pro specializované virologické laboratoře. V případě viru Zika se pro VNT používají buněčné linie CV-1 (buňky opičích ledvin) nebo PS (prasečí ledviny) a jako virová suspenze slouží prototypový kmen viru Zika MR766. Samotný test provádíme v mikromodifikaci na sterilních 96jamkových mikrotitračních destičkách. Vyšetřované sérum dávkujeme ve dvojnásobných ředěních a stanovujeme nejvyšší ředění séra, které ještě neutralizuje cytopatický efekt viru minimálně z 50 %. Převrácená hodnota tohoto ředění se označuje jako virusneutralizační titr. Pro vizualizaci reakce používáme neutrální červeň, která obarví pouze vitální buňky, u kterých nenastal cytopatický efekt, což nám umožňuje makroskopické odečítání výsledků bez nutnosti používání mikroskopu36, viz obr. 4.
Vyšetření asymptomatických osob po návratu z endemických oblastí
Asymptomatičtí cestovatelé jsou ve většině případů vyšetřováni na vlastní žádost jako samoplátci. Laboratorní vyšetření má opodstatnění pouze u těhotných žen, jejich sexuálních partnerů a u párů plánujících graviditu. V prvé řadě je nutno žadatelům vysvětlit možnosti a limity laboratorního vyšetření a odběr vzorku správně načasovat. Je nutno také vyloučit zbytečná vyšetřování u lidí, kteří se pohybovali pouze v neendemických oblastech – aktuální situaci lze ověřit na webu ECDC. U asymptomatických osob není indikováno vyšetření metodou RT-PCR, protože dobu virémie bez přítomnosti příznaků nelze určit. V těchto případech provádíme pouze vyšetření protilátek v séru, a to detekci IgG a IgM metodou ELISA (popřípadě NIF) vždy současně s konfirmací metodou VNT. Odběr krve se provádí nejdříve za 3 týdny po návratu z endemické oblasti. Až do obdržení definitivních negativních výsledků (IgG, IgM i VNT) je nutno dodržovat opatření pro zabránění sexuálního přenosu nákazy, tedy sexuální abstinenci nebo chráněný pohlavní styk s kondomem. Pokud cestovatelé z endemických oblastí laboratorní vyšetření nepodstoupí, je doporučená doba těchto ochranných opatření minimálně 6 měsíců po návratu. 6měsíční ochranná lhůta platí i pro osoby s pozitivním výsledkem sérologického vyšetření. Doporučené diagnostické postupy v různých situacích jsou shrnuty v tabulce 3.
Výsledky
V období od února do října 2016 bylo v NRL pro arboviry vyšetřeno celkem 227 vzorků metodou RT-PCR na detekci RNA viru Zika, z toho bylo 163 vzorků krve, 57 vzorků moči, 6 vzorků spermatu a 1 vzorek z pitvy. Pozitivních bylo 12 vzorků od 8 pacientů – 4 vzorky krve, 6 vzorků moče a 2 vzorky spermatu. Na stanovení protilátek IgG a IgM proti viru Zika bylo za stejné období vyšetřeno 769 vzorků krve. Byly použity ELISA soupravy využívající NS-1 antigen. Z to-ho bylo ve třídě IgG pozitivních 26 vzorků, hraničních 13 a negativních 730. Ve třídě IgM bylo pozitivních 25 vzorků, 9 hraničních a 735 negativních. Metodou VNT bylo za stejné období vyšetřeno 733 vzorků, z toho u 44 byl pozitivní výsledek, u 38 hraniční a u 651 negativní výsledek.
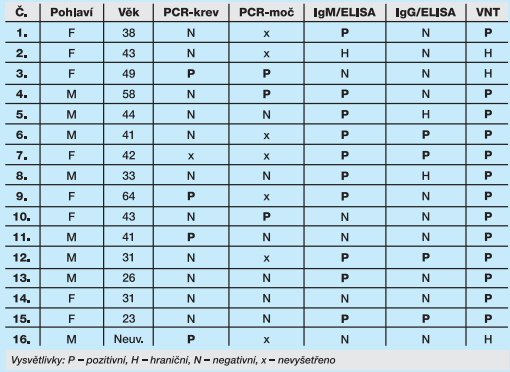
Akutní infekce virem Zika byla dosud prokázána u 16 pacientů, z nichž 7 se podařilo diagnostikovat na základě pozitivity RT-PCR z krve nebo z moči, přičemž 5 pacientů s pozitivitou RT-PCR mělo současně již při prvním odběru pozitivní protilátky – 2 měli v prvním vzorku pozitivní IgM i VNT, 3 pouze VNT, zbývající 2 měli VNT hraniční, IgM i IgG negativní. U 9 pacientů byla akutní infekce Zika prokázána pouze na základě sérologie. Výsledky pacientů s akutní infekcí při prvním odběru shrnuje tabulka 4.
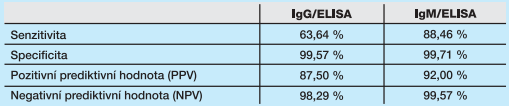
Porovnáním s klinickými údaji vyšetřených osob a s výsledky konfirmačního testu VNT byly pro použité sérologické metody stanoveny hodnoty specificity, senzitivity, pozitivní prediktivní hodnoty (PPV) a negativní prediktivní hodnoty (NPV) pomocí vzorců uvedených pod tabulkami 4 a 5. Do hodnocení byly zařazeny pouze vzorky, u kterých byly provedeny všechny 3 sérologické testy (IgG/ELISA, IgM/ELISA a VNT). Vyřazeny byly vzorky s hraničními výsledky. Do hodnocení bylo zařazeno 724 vzorků pro IgG/ELISA a 726 vzorků pro IgM/ELISA. Výsledky jsou uvedeny v tabulkách 5, 6, 7.


Diskuze a závěr
Dosavadní výsledky potvrzují, že laboratorní diagnostika infekcí virem Zika musí být komplexní a opírat se o přímé i nepřímé metody průkazu infekce. Metoda RT-PCR je vzhledem ke krátké době virémie vyhrazena pouze pro akutní symptomatické infekce a vždy musí být doplněna i sérologickým vyšetřením včetně VNT. Použité ELISA soupravy mají díky použití NS-1 antigenu vysokou specificitu, avšak potvrdila se nižší citlivost těchto testů, které musí proto být vždy doplněny i o VNT, který je citlivější metodou ve srovnání s testy ELISA.

Vzhledem k tomu, že náš soubor obsahuje jen velmi malý podíl pozitivních vzorků, mohou být vypočtené hodnoty poněkud zkreslené. Do hodnoceného souboru nebyly zařazeny vzorky s hraničními výsledky, protože jejich interpretace je nejasná. V případě hraničních výsledků požadujeme odběr dalšího vzorku, avšak v praxi je druhý vzorek zaslán jen u malého počtu osob, proto nelze jednoznačně určit, zda je hraniční výsledek odrazem nízké hladiny protilátek, nebo jde o nespecifickou reakci. S hraničními výsledky se nezřídka potýkáme i u konfirmačního testu VNT, v těchto případech je pro interpretaci zásadní informací údaj o absolvovaném očkování proti jiným flavivirům a o prodělaných flavivirových infekcích, protože tyto okolnosti mohou způsobovat zkřížené reakce i v testu VNT. Hraniční výsledek u osoby s negativní anamnézou stran předchozí expozice flavivirům představuje větší pravděpodobnost, že se skutečně jedná o nízkou hladinu protilátek proti viru Zika, což se potvrdilo u několika pacientů v časné fázi infekce Zika. Otázkou je, zda při asymptomatické infekci je virémie nižší než u symptomatických průběhů a zda i množství vytvořených protilátek je u těchto osob nižší. To by vysvětlovalo nízce pozitivní až hraniční výsledky VNT u některých asymptomatických jedinců po návratu z endemických oblastí. Vzhledem k tomu, že tyto otázky nejsou zatím zodpovězeny, doporučujeme zachovávat preventivní opatření proti sexuálnímu přenosu nákazy po dobu 6 měsíců u osob s pozitivními i hraničními výsledky v testu VNT.