Historické milníky
Od objevu protilátek Emilem von Behringem uběhlo více než 120 let, přičemž alespoň částečné diagnostické i terapeutické využití přišlo až po roce 1950. Frakcionace plazmy, přesněji řečeno Cohn-Oncleyova frakcionace, pomohla z větší části vyřešit problém ohledně izolace a purifikace imunoglobulinů od lidských dárců či zvířat. Izoláty se tak postupně zaváděli do medicínské praxe ve smyslu substituční léčby nebo pasivní imunizace.
V laboratorní diagnostice našly protilátky využití v imunochemických metodách, například imunoprecipitaci na gelu, v roztoku. Protilátky v té době bohužel byly polyspecifického eventuálně monospecifického charakteru. Teprve od poloviny sedmdesátých let jsme si osvojili postupy, které vedou k jejich cílené produkci. Cílenou produkci teď chápejme jako naše možnosti výroby imunoglobulinů o chtěném izotypu a chtěné antigenní specifičnosti, aby použití bylo standardnější.
Protilátky v diagnostice in vitro

První metodou, která umožnila imunoglobuliny produkovat nejen ve velkém množství ale i jednotné specifičnosti vůči předem vybrané antigenní determinantě, byl proces známý pod termínem technologie buněčných hybridomů. Za objevem stál Cesar Milstein společně s Georgem Köhlerem. Umožnili tak výrobu monoklonálních protilátek (mAb), které se vyznačují specifičností vůči jednomu epitopu téhož antigenu. Uplatnění nalezly především v laboratorní diagnostice, kde limity klasické substrátové chemie pochopitelně nedovolovaly analyzovat hormony, vitaminy, léčiva a v neposlední řadě infekční markery. Díky technologii máme k dispozici protilátky, které výše uvedené analyty dokáží standardně in vitro vyvazovat, což je základní předpoklad ke vzniku imunochemické reakce s následným stanovením. Pro takové metody používáme obecný termín immunoassay.
Diagnostické protilátky od jednotlivých výrobců vykazují funkční rozdíly. Záleží na tom, jaký epitop na antigenní struktuře rozeznávají. Nezapomeňme, že mezi antigeny v našem případě řadíme i endogenní molekuly, jež pro člověka nemají imunogenní charakter. Zajímavý příklad představuje methotrexát. Léčivo je analogem folátu s účinkem antimetabolitu využívaným jako cytostatikum nebo imunosupresivum. Oproti folátu methotrexát zhruba v polovině molekuly obsahuje navíc CH3 skupinu. Existují protilátky, jejichž vazebná místa dokáží molekuly vzájemně odlišit a umožňují tak sledování plazmatické hladiny léčiva i kyseliny listové. Nicméně v praxi se můžeme setkat s nedostatečnou specifičností diagnostik.
Mnoho léčiv způsobuje interference. Za zmínku stojí pseudoefedrin, selegilin či bupropion, které kvůli své struktuře mohou zkříženě reagovat s protilátkami ke stanovení amfetaminů. Vzniká tak falešná pozitivita. Opačná situace nastává u falešné negativity. Kupříkladu australský antigen (HBsAg) viru hepatitidy typu B, ač velmi sporadicky podléhá mutaci. V pozici 145 proteinového řetězce dojde k výměně argininu za glycin. Jelikož oblast 140 až 145 je epitopem pro některá diagnostika, v případě záměny aminokyselin imunochemická reakce neproběhne.
Technologie buněčných hybridomů
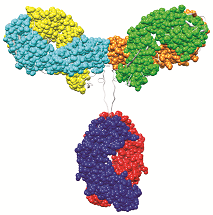
Y-tvaru protilátky
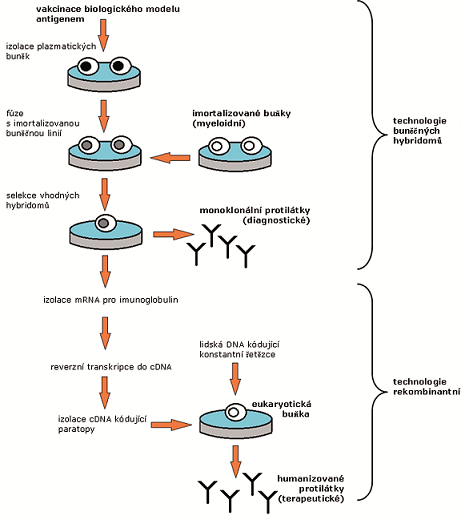
Buněčný hybridom vzniká fúzí plazmatické buňky s imortalizovaným leukocytem například vycházejícím z myeloidní linie. Vše začíná vakcinací biologického modelu - nejčastěji myši, potkana nebo křečka. Zvíře po zpracování antigenu produkuje imunokompetentní buňky, mezi nimiž jsou i aktivované B-lymfocyty. Buňky získáme ze sleziny biologického modelu a potřebujeme je imortalizovat, aby fungovaly jako dlouhodobý zdroj protilátek. V tom nám pomůže jejich fúze s nádorově transformovanými buňkami myeloidní řady, jež postrádají Hayflickův limit, tedy neomezeně proliferují. Samotné spojení buněk lze navodit přítomností polyethylenglykolu nebo inaktivovaným Sendai virem (SeV), jehož přítomnost indukuje vznik syncytií.
V buněčné kultuře nám tedy vznikají tři typy hybridomů: plazmatická buňka-plazmatická buňka, plazmatická buňka-myeloidní buňka a myeloidní buňka-myeloidní buňka. Nás ovšem zajímají jen plazmocyty fúzované s myeloidními buňkami. K jejich separaci lze použít selekční médium, přesněji řečeno HAT médium. Využívá skutečnosti, že obsah hypoxantinu, aminopterinu a tymidinu buňkám inhibuje syntézu guanosinu a zamezuje tak proliferaci. V takovém případě klasické buňky mohou zapojit enzym HGPRT (hypoxantinguaninfosforibozyltransferázu) schopný inhibici obejít. Nicméně při fúzi se používají myeloidní HGPRT negativní mutanty, takže produkce guanosinu opravdu není možná a v médiu hynou. Poněvadž izolované myší lymfocyty HGPRT přirozeně obsahují, v kultivačním médiu získávají selekční výhodu, kterou předají myeloidním buňkám. Ovšem za předpokladu, že fúzují. Teď už není problém dosáhnout selekce požadovaných hybridomů, protože vzájemně spojené myeloidní buňky trpí absencí metabolické dráhy a spojené lymfocyty bez patřičné stimulace postrádají dostatečný stupeň viability. Jen chtěné hybridomy disponují dostatečnou proliferační aktivitou. K poslednímu kroku náleží výběr buněk, které syntetizují imunoglobuliny namířené k požadovanému epitopu. Toho dosáhneme pasážováním a imunochemickým testováním jednotlivých linií.
Využití protilátek in vivo
Jak bylo uvedeno, technologie nám dokáže poskytnout protilátky ve velkém množství s možností výběru antigenní determinanty, k níž budou afinovat. Praktické využití nacházejí jen v in vitro aplikacích čili diagnostice. Bohužel užití in vivo za účelem léčby je značně limitováno. Pro lidský organismus jsou molekuly zcela xenogenní. Po parenterálním podání u lidí navozují imunologickou odpověď ve smyslu tvorby vlastních protilátek (human anti-mouse antibodies), což vede k jejich rychlé eliminaci ještě před nástupem vlastního farmakodynamického efektu. Navíc u jedinců s dispozicí mohou indukovat systémovou alergickou reakci neboli anafylaxi eventuálně tvorbu imunokomplexů.
Chimérické a humanizované protilátky
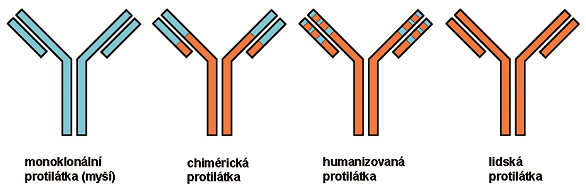
Zmíněné problémy pomohly vyřešit tzv. chimérické a humanizované monoklonální protilátky. Postup vedoucí k jejich výrobě snoubí technologii buněčných hybridomů s technologií rekombinantní, při níž do buňky vkládáme cizí gen kódující vznik cizího proteinu. Klasické hybridomy totiž syntetizují imunoglobuliny na podkladě své DNA, která je podle dogmatu molekulární biologie transkribována do RNA a posléze podrobena translaci za vzniku proteinových řetězců. Není tedy těžké intracelulární RNA kódující protilátky izolovat. Další krok spočívá v reverzní transkripci získané RNA zpět do komplementární DNA (cDNA). Určitý úsek komplementární DNA koresponduje s myší protilátkou v oblasti, kde se váže s antigenem čili Fab úsekem. DNA je zapotřebí amplifikovat PCR metodou, aby genetický materiál z hybridomu nahradil ty části genu, které jsou zodpovědné za syntézu oblastí Fab v lidské protilátce. Výsledná protilátka vazebnými oblastmi tedy odpovídá myším sekvencím aminokyselin a ostatní části molekuly analogicky kopírují klasický lidský imunoglobulin (Obr. 1).
Podle stupně náhrady pak můžeme hovořit o chimérickém nebo humanizovaném typu molekuly. U obou typů dojde k výměně řetězců v konstantní oblasti (Fc), což můžeme označit za nejdůležitější. Tím získají zpravidla izotyp IgG1, který dobře aktivuje komplement klasickou cestou i cytotoxické mechanismy buněčné imunity. Pokud vyvazují solubilní antigeny, vzniklé imunokomplexy následně vychytává retikuloendotelový systém (RES) prostřednictvím makrofágů. Pohlcené protilátky nebo jejich zbytky na buněčné úrovni katabolizuje ubikvitinový degradační systém. Další oblast Fab účastnící se vazby s epitopem může zůstat myší, a pak hovoříme o chimérických protilátkách. Odlišná situace nastává u humanizovaných protilátkek. Uvědomme si, že celý fragment Fab nepodléhá vazbě s antigenem. Proto lze tyto nepodstatné části také nahradit lidským řetězcem. Vznikne protilátka v níž původní (myší) zůstanou jen ty části Fab, které bezprostředně participují na vazbě s epitopem. Stupeň humanizace dosahuje až 96 procent, což znemožňuje lidskému imunitnímu systému zásadněji reagovat. Naproti tomu chimérické protilátky bývají homologní ze 75 procent. Zjednodušeně můžeme říci, že u chimérického typu zůstává více oblastí myšího původu než u humanizovaného (Obr. 2).
Příklady terapeutických protilátek
Jako každá léčiva je zapotřebí i terapeutické imunoglobuliny označit generickým názvem. Obecně se přijalo pravidlo, že k názvu protilátky přidáváme koncovku -mab, například omalizumab. Pro upřesnění obsahují humanizované typy delší koncovku -umab, chimérické -ximab. V současnosti přibývá nově registrovaných léčiv, nicméně pozornost věnujeme jen několika z nich. Je překvapivé, že jen jeden preparát s humanizovanou monoklonální protilátkou je určený k léčbě infekčního onemocnění. Palivizumab (Synagis®) neutralizuje respirační syncytiální virus (RSV), který navozuje infekci dolních dýchacích cest. U imunosuprimovaných pacientů či kojenců může mít fulminantní průběh. RSV na povrchu obalu vystavuje G-glykoprotein zodpovědný za adhezi k buňce a F-protein. Protektivní efekt léčiva spočívá v asociaci právě s F-proteinem, jež zodpovídá za průnik viru do buňky i pozdější vznik syncytií.
Omalizumab (Xolair®) je anti-IgE protilátkou humanizovaného typu. Zlepšuje stav pacientů s dekompenzovaným astmatem, kde selhala dosavadní konvenční léčba. Na astmatu jakožto imunopatologické reakci typu I participují molekuly izotypu IgE. Omalizumab cirkulující IgE vyvazuje za vzniku solubilních komplexů následně vychytávaných retikuloendotelovým systémem. Protože afinuje k IgE exprimovaným i na aktivovaných B-lymfocytech, tlumí syntézu nových protilátek. Výsledkem obou mechanismů účinku je zlepšení klinického stavu pacienta. K terapii chronických zánětlivých stavů, jako je například revmatoidní artritida, máme k dispozici tocilizumab (RoActemra®). Obvykle se podává v kombinovaném režimu s methotrexátem, mnohdy v případech, kdy pacient vykazuje rezistenci k dosavadní biologické léčbě antagonisty TNF-alfa. Tocilizumab charakterizujeme jako humanizovanou monoklonální protilátku. Molekula blokuje transmembránové receptory pro interleukin 6 (IL-6R) exprimované především na mononukleárech, fibroblastech eventuálně buňkách endotelu, a tím navozuje antiflogistický efekt.
Příkladem zmiňovaných antagonistů TNF-alfa může být adalimumab (Humira®). Obecně tyto blokátory TNF-alfa inhibují buď samotný receptor, nebo jeho příslušný ligand, což také tlumí patogenezi zánětu. Výhoda adalimumabu spočívá v širším indikačním spektru zánětlivých nemocí, jako je Crohnova choroba či psoriáza. Velký počet registrovaných preparátů je indikován k onkologické léčbě. Na molekulární úrovni jsme totiž poznali mnoho receptorů eventuálně jejich ligandů souvisejících s nádorovou transformací buněk. Bevacizumab (Avastin®) je humanizovanou monoklonální protilátkou potlačující angiogenezi, která doprovází růst většiny solidních nádorů. Díky tomu jsou pokryty jejich nutriční požadavky.
Na novotvorbě krevních cév participuje především vaskulární endotelový růstový faktor (VEGF). Mimo něj můžeme ještě zmínit transformační růstový faktor (TGF-beta), eventuálně destičkový růstový faktor (PDGF). Společně pozitivním způsobem modulují endotelové buňky, jež jsou mezenchymálního původu. Léčivo s vaskulárním endotelovým růstovým faktorem vytváří komplex. Příslušné receptory na endotelu, k nimž řadíme dva typy (VEGFR1, VEGFR2), postrádají agonistický efekt růstového faktoru. Důsledkem je nedostatečné cévní zásobení nově vznikající nádorové tkáně. Snížená angiogeneze prokazatelně prodlužuje přežití pacientů s kolorektálním karcinomem (nejčastěji se bevacizumab podává v kombinovaném režimu s 5-fluorouracilem) a pravděpodobně prokáže efekt u pankreatického adenokarcinomu, světlobuněčného karcinomu ledviny či nemalobuněčného karcinomu plic.
Rituximab (MabThera®) řadíme k chimérickým monoklonálním protilátkám. Protože afinuje k povrchové molekule CD20, kterou zvýšeně exprimují buňky lymfomu vycházející z B-lymfocytů, je indikován k terapii tohoto onemocnění. Vazba imunoglobulinu čili opsonizace následně spouští imunitní procesy na podkladě aktivace komplementu nebo přímé cytotoxicity vedoucí k eliminaci nádorově transformovaných buněk v lymfatické tkáni.
Výhled do budoucna
V současnosti rozvoj biotechnologií v oblasti konstrukce imunoglobulinů umožňuje jejich cílenou výrobu vůči molekulám, jež sehrávají roli v patogenezi řady chorob. Po ukončení klinických studií můžeme očekávat markantní nárůst terapeutických protilátek s širokým spektrem indikací. Druhá oblast vývoje pravděpodobně bude zaměřena na prodloužení biologické dostupnosti léčiva. Stejně jako ostatní proteiny krevní plazmy i protilátky podléhají katabolickému působení proteáz, což jejich působení v organismu zkracuje. Častější aplikace léčiva pak pro pacienty může znamenat diskomfort. Řešením by mohla být pegylace, tak jako je tomu u interferonů (Pegasys®). Polyethylenglykol můžeme navázat díky jeho hydroxylovým skupinám k proteinovému řetězci imunoglobulinu a zmírnit tak dopad aktivity proteáz. Prozatím jedinou terapeutickou protilátku modifikovanou pegylací a tedy s delším působením v organismu představuje certolizumab (Cimzia®). Přesněji řečeno jde o pegylovaný Fab fragment.