
Hemoterapie představuje důležitou část zdravotních služeb poskytovaných významné skupině léčených nemocných. Jedná se o léčbu transfuzními přípravky a krevními deriváty, která až na výjimky splňuje kritéria substituční terapie.
Zatímco krevní deriváty, kterými jsou koncentráty albuminu, imunoglobulinů, koagulačních faktorů, přirozených inhibitorů koagulace a tkáňová lepidla, jsou vyráběny komerčně ve frakcionačních centrech a jsou povinně ošetřovány metodami inaktivace patogenů, transfuzní přípravky (erytrocyty, trombocyty, plazma, případně granulocyty a kryoprecipitát) jsou vyráběny v zařízeních transfuzní služby a v České republice nejsou v současnosti povinně ošetřovány metodami inaktivace patogenů. Z uvedeného vyplývá, že krevní deriváty jsou mnohem bezpečnější z hlediska možného přenosu krví přenosných agens než transfuzní přípravky.
Hemoterapie je tradičně spojována s riziky, jejichž charakter i význam se v průběhu historie měnil. Jediné původně známé riziko bylo spojováno s podáním inkompatibilní transfuze krve v systému AB0. Toto imunologické riziko bylo odhaleno krátce po objevu krevních skupin v roce 1901. V současné době se rizika hemoterapie orientují opět na nežádoucí reakce imunologického charakteru a na riziko chyby jedince, který do procesu hemoterapie vstupuje, respektive hemoterapii realizuje. Infekční rizika provázejí hemoterapii od jejího počátku až do současnosti. Ke známým infekčním agens, jejichž přenosy se podařilo v minulosti významně omezit, přibyla v novém tisíciletí infekční rizika nová (viz tabulka 1).
Bezpečnost hemoterapie velmi významně ovlivňuje míra standardizace všech procesů, které s ní souvisejí; klíčovou roli představuje úroveň správné výrobní praxe při výrobě transfuzních přípravků a krevních derivátů a také samozřejmě zdroj, ze kterého je lidská krev a/nebo plazma pro výrobu transfuzních přípravků a krevních derivátů získávána, tedy dárci krve. Důležitými postupy ve výrobě, pomocí nichž lze infekční rizika hemoterapie významně snížit, jsou mimo jiné: pečlivý výběr dárců krve a/nebo plazmy a způsob (systém) vyšetřování krve dárců na přítomnost definovaných známek krví přenosných infekcí. V České republice tento postup určuje vyhláška č. 143/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidské krve a jejích složek v platném znění (vyhláška o lidské krvi), která vychází z požadavků směrnic Evropského parlamentu a Rady Evropy, jež je prováděcí vyhláškou zákona č. 378/2007 Sb., o léčivech v platném znění, a ukládá při každém odběru provést vyšetření diagnostických vzorků získaných od dárce, zahrnující vyšetření k průkazu známek infekce virem lidského imunodeficitu typů 1 a 2 (HIV 1 a 2), a to metodou stanovení protilátky a antigenu p24, virem hepatitidy typu B (HBV), a to metodou stanovení povrchového antigenu, virem hepatitidy typu C (HCV), a to metodou stanovení protilátky, a syfilis, a to metodou stanovení specifické protilátky proti Treponema pallidum.

Nevýhodami sérologického screeningu dárců krve jsou diagnostická okna při průkazu anti-HCV, anti-HIV 1/2, HIV p24 antigenu, HBsAg a další problémy při detekci HBsAg, které mohou komplikovat mutace virového genomu, či přítomnost okultní hepatitidy B (OBI – occult hepatitis B infection). Mnohé studie prokázaly, že zavedení molekulárních technik pro přímý průkaz nukleových kyselin virů (HIV RNA, HCV RNA, HBV DNA) může snížit riziko přenosu těchto virů transfuzí, pokud je darování krve realizováno v období diagnostického okna.
NAT (nucleic acid testing) technologie byly zavedeny pro zvýšení bezpečnosti poolů plazmy v evropských frakcionačních centrech v devadesátých letech minulého století. Vyšetřování dárců krve NAT technologií bylo poprvé jako rutinní screeningová metoda zavedeno v Německu v roce 1997; od roku 1999 i v dalších zemích světa. V současnosti je celosvětově NAT technologie pro vyšetření dárců krve realizována u dvou třetin všech odběrů krve pro výrobu transfuzních přípravků; v Evropě se stále zvyšuje počet zemí, které NAT technologie u dárců krve implementují i přesto, že závazné předpisy Evropské unie NAT vyšetření u dárců krve nevyžadují.
V současné době jsou v Evropě dostupné dva komerční systémy pro multiplexní NAT (HIV, HBV, HCV), které disponují CE certifikátem, jenž opravňuje jejich použití pro screening dárců krve v zařízeních transfuzní služby. Jedním z nich je cobas® s201 (ROCHE), který je primárně určen pro multiplexní NAT vyšetření v poolech po 1, 6, 24 nebo 96 vzorcích pro detekci HIV-1, HCV, HBV a v poolech po 96 nebo 480 vzorcích pro detekci parvoviru B19 a HAV. Pro použití na systému cobas® s201 je určena in vitro diagnostika cobas® TaqScreen MPX Test pro přímé zjištění RNA viru HIV-1 skupiny M a skupiny O, RNA viru HIV-2, RNA viru hepatitidy C (HCV) a DNA viru hepatitidy B (HBV) a in vitro diagnostika cobas® TaqScreen DPX Test k přímé simultánní detekci DNA parvoviru B19 (B19V) a RNA viru hepatitidy A (HAV) v jednotlivých vzorcích nebo poolech plazmy. V případě potřeby je možné další rozšíření systému, a to využitím in vitro diagnostiky cobas® TaqScreen West Nile Virus Test k přímé detekci RNA horečky západního Nilu (WNV).
S důrazem na zvýšení bezpečnosti transfuze implementovala v minulosti dvě zařízení transfuzní služby v ČR – nezávisle na sobě – NAT technologie pro rutinní screeningové vyšetřování dárců krve. Prvním zařízením bylo Transfuzní a tkáňové oddělení Fakultní nemocnice Brno (TTO FN Brno), ve kterém bylo zahájeno NAT vyšetření (HIV RNA, HCV RNA, HBV DNA) v říjnu 2010. V říjnu 2013 byla stejná technologie pro rutinní screeningové vyšetřování dárců krve implementována v Oddělení hematologie a krevní transfuze Ústřední vojenské nemocnice Praha (OHKT ÚVN Praha). Od února 2014 je navíc v OHKT ÚVN Praha NAT technologie využívána k detekci dalších krví přenosných infekcí, a to HAV RNA (virová hepatitis A) a B19V DNA (parvovirus B19). Obě laboratoře jsou vybaveny systémem cobas® s201 (ROCHE) s kapacitou vyšetření několika tisíc vzorků denně; obě laboratoře disponují shodným laboratorním informačním systémem TIS s možností expedice výsledku laboratorního vyšetření elektronickou cestou. Kapacitně by definované laboratoře byly schopny zajistit rutinní NAT screeningové vyšetřování definovaných virů u dárců krve pro celou ČR, samozřejmě po nezbytné synchronizaci procesů a režimů.
V ČR je ročně realizován přibližně jeden milion odběrů krve a jejích složek; z části odběrů jsou vyrobeny transfuzní přípravky pro klinické použití; část plazmy, která pro klinický účel není potřebná, slouží k výrobě krevních derivátů. V ČR je transfuzní služba značně diverzifikována – 85 subjektů různých zřizovatelů s rozdílnými spektry a úrovní poskytovaných služeb. Taková organizace neumožňuje standardizaci produkce a procesů zásobování, efektivní zavádění nových postupů a technologií nebo pružnou reakci na aktuální epidemiologickou situaci. V ČR není prováděn benchmarking, není zajištěna finanční efektivita výroby transfuzních přípravků a nejsou racionálně využívány jednotlivé registry dárců krve. U poskytovatelů s komplexními onkologickými centry jsou registry dárců krve využívány maximálně, zatímco dárci krve mimo centra jsou odmítáni. Ve většině států Evropy je transfuzní služba řízena centrálně a/nebo regionálně s důrazem na spolupráci jednotlivých subjektů. Takové uspořádání přináší finanční úspory a zvyšuje bezpečnost hemoterapie díky postupům, kterými jsou: univerzální deleukotizace transfuzních přípravků, postupy pro redukci výskytu TRALI (transfusion related acute lung injury), skladování destičkových koncentrátů v náhradních roztocích a detekce jejich případné bakteriální kontaminace, používání patogen redukčních technologií a zejména rutinní screening krve dárců pro definované infekce pomocí NAT technologií.
Riziko přenosu virové hepatitidy transfuzí je v ČR 1 : 300 000. Zatímco přenos HBV a HCV transfuzí v ČR je v jednotlivých případech téměř každoročně zaznamenán, přenos HIV transfuzí nebyl v ČR dosud popsán, přestože byl v roce 2005 ve FN Brno k hemoterapii vydán jeden prokazatelně HIV pozitivní transfuzní přípravek (příjemce transfuze se prokazatelně nenakazil). Dárcem krve byl mladý muž, který daroval svoji krev v období realizace nechráněného intimního styku s jiným HIV pozitivním mužem. Sérologickými testy nebylo možno přítomnost HIV v jeho krvi detekovat, neboť dárce daroval svoji krev brzy po infekci v období diagnostického okna; technologie NAT by přítomnost HIV v jeho krvi prokázala (kdyby byla v té době v TTO FN Brno používána) a k výdeji HIV pozitivního transfuzního přípravku by nedošlo. Tyto skutečnosti byly zjištěny dodatečně, a to vyšetřením archivních krevních vzorků pomocí NAT technologie.
Další negativní zkušenost je z roku 2008, rovněž z FN Brno, kdy v době vrcholící epidemie hepatitidy A na území ČR byly k hemoterapii ve FN Brno vydány HAV pozitivní erytrocyty. V tomto případě k přenosu infekce došlo a čtyřletá holčička s diagnózou maligního onemocnění musela překonávat v průběhu intenzivní léčby další překážku – akutní hepatitis A, přestože byla v minulosti proti HAV očkována. Ve FN Brno existuje také další historická negativní zkušenost, která se týká dárce krve s OBI, kdy v průběhu let 2002–2007 došlo k nákaze hepatitis B transfuzemi u čtyř pacientů. Bohužel přítomnost OBI byla u dárce krve zjištěna až dodatečně, a to na základě hlášení podezření na přenos hepatitis B po transfuzích. Ani poslední zaznamenané tři přenosy HCV transfuzemi trombocytů na tři děti – všechny s diagnózou maligního onemocnění – a následná profesionální nákaza HCV zdravotní sestry ve FN Motol v roce 2015 nejsou dostatečným impulzem pro zavedení screeningového testování dárců krve v ČR pomocí NAT technologie přesto, že pomocí této technologie by HCV RNA v krvi dárce byla jednoznačně prokázána a k přenosům infekce by nedošlo.

Skutečnost, že krev dárců není v ČR vyšetřována pomocí NAT technologie k průkazu definovaných krví přenosných agens obdobně, jak se děje v sousedních státech EU, komplikuje nejen hemoterapii, ale i pravidelné zásobování spojeneckých vojsk transfuzními přípravky v rámci zahraničních misí a také případnou internacionální pomoc při hromadné havárii nebo teroristickém útoku. Další nepříznivou okolností je nepřipravenost ČR na případnou potřebu neprodleného zahájení screeningového NAT testování dárců krve, a to z důvodu nepříznivé epidemiologické situace. Takovými mohou být například epidemie hepatitidy A na území státu nebo zaznamenaný přenos WNV transfuzí, ale i mnoho dalších, mezi které je třeba zahrnout také globalizační a behaviorální trendy i migrační vlny. Diverzifikace jednotlivých zařízení transfuzní služby v ČR neumožňuje implementaci NAT technologie do rutinní praxe v časovém rámci několika dnů či týdnů, což v budoucnu může s ohledem na výše uvedené představovat problém.
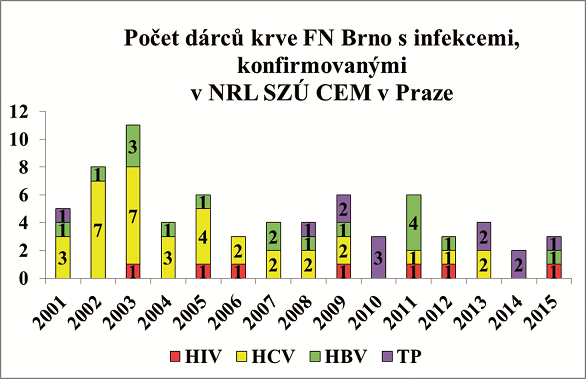
Záchyt testovaných infekcí u dárců krve není raritní, což dokládají výsledky analýzy z let 2001–2015 z TTO FN Brno (viz obrázek). Ve sledovaném období byly detekovány prodělané či aktivní infekce (HIV, HCV, HBV, syfilis) u 72 osob – dárců krve, z toho u 55 mužů a 17 žen. 33 osob darovalo krev poprvé, 39 osob bylo opakovanými dárci krve. Nejvíce bylo zachyceno osob s infekcí HCV, a to 36, 17 osob s infekcí HBV, 12 osob s prodělanou a/nebo aktivní syfilis. Celkem 7 osob bylo zachyceno s HIV pozitivitou – všechny osoby byly mužského pohlaví a opakovanými dárci krve (!); 6 z nich v následném rozhovoru přiznalo MSM (men who have sex with men), i když všechny HIV pozitivní osoby v dotazníku dárce krve odpověděly, že se cítí být bezpečnými dárci z pohledu možného rizika přenosu infekce svojí krví na pacienta, příjemce transfuzního přípravku. U 70 osob byla zjištěna infekce pomocí sérologických screeningových testů. U dvou osob byla detekována přítomnost HBV DNA při současné negativitě sérologického testu HBsAg.
Přenosem infekce transfuzí jsou v ČR ohroženi nejvíce onkologičtí pacienti jako frekventní příjemci transfuzí, což může jejich nepříznivý zdravotní stav dále komplikovat. Dle názoru autorky by bylo možné zvýšit bezpečnost hemoterapie rozšířením algoritmu vyšetřování krve dárců o povinnou detekci nukleových kyselin minimálně tří původců krví přenosných infekcí (HBV, HCV a HIV), aniž by při rozumném organizačním modelu transfuzní služby v ČR představovalo toto rozšíření testování neúměrné zvýšení nákladů.