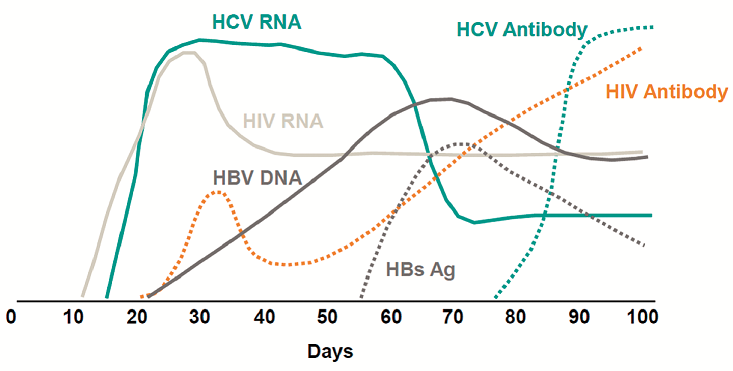
Zdroj: Busch M. P., Closing the Windows of Viral Transmission by Blood Transfusion, AABB, 20013
Podání krevní transfuze je nutné stále považovat za rizikový výkon. Velikost rizika lze minimalizovat, ale nelze jej nikdy zcela vyloučit. Důvodem je skutečnost, že odebraná krev nebo její složky a transfuzní přípravky z nich vyrobené není možné při zachování jejich léčebného účinku současnými výrobními postupy upravit tak, aby se známá rizika zcela odstranila.
Z mnoha možných nežádoucích účinků krevní transfuze je mimořádně závažné riziko přenosu infekcí. Kontaminované krevní transfuze jsou celosvětově stále příčinou řady nových nákaz příjemců. Postupů k omezení infekčních rizik transfuzí je celá řada. Jedná se v prvé řadě o důsledný výběr dárců s důrazem na bezpříspěvkové dárcovství, provádění screeningového vyšetřování dárců, deleukotizace transfuzních přípravků, používání patogen-redukčních technik a sledování a vyhodnocování nežádoucích vlivů transfuzí prostřednictvím hemovigilančních dat.
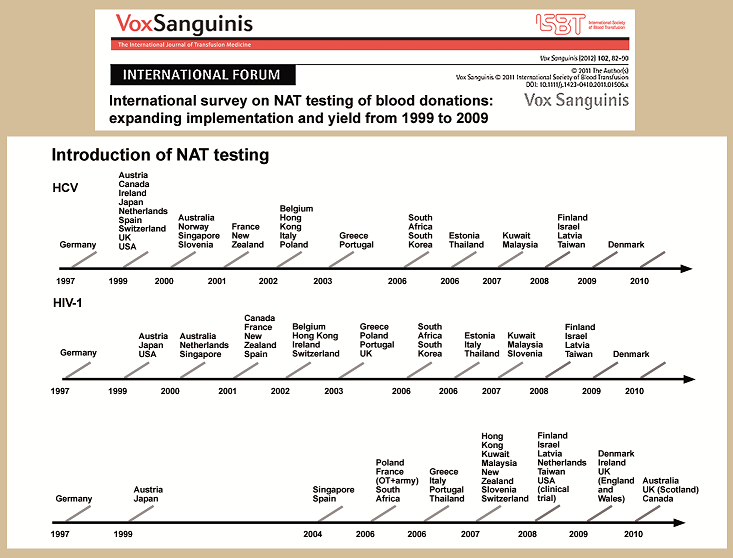
Zdroj: VoxSanguinis4
Základem laboratorního screeningu dárců krve na krví přenosné infekce jsou sérologická vyšetření, která jsou ale zatížena rizikem diagnostického okna (HIV 2–3 týdny, HBV 4–6 týdnů, HCV 2–6 měsíců). Možností, jak toto riziko snížit, je rozšíření screeningu o molekulárně biologické metody, kterými se zjišťuje přímo přítomnost nukleové kyseliny daného viru (Nucleic acid testing – NAT). Citlivost těchto metod je vyšší, což umožňuje zkrácení diagnostického okna (u HIV o 7–9 dnů, HCV o 59–65 dnů a HBV o 25–30 dnů), viz obr. 1. Značná část zemí světa proto v posledních 15 letech k sérologickým testům zavedla i rutinní vyšetření NAT a v transfuzní službě jsou tato vyšetření již pokládána za standard, viz obr. 1 a 2.
V ČR je testování dárců krve na krví přenosné infekce založeno na povinném minimu, tj. na sérologickém vyšetření HBsAg, anti-HCV, anti-HIV 1/2 + Ag p24 a syfilis. Rozšíření testování o další metody je již několik let na úrovni odborné společnosti a MZ pouze diskutováno, ačkoli promořenost české populace např. VHC činí cca 10 případů na 100 tisíc obyvatel a představuje tak epidemiologický i transfuziologický problém. Infekce HIV je na pokračujícím vzestupu, který má exponenciální charakter. Nárůst infekce HIV i HCV v obecné populaci ČR zvyšuje její prevalenci i mezi dárci krve, viz obr. 4 a 5.
Výjimkami z výše uvedeného jsou v ČR transfuzní přípravky vyrobené ve dvou zařízeních transfuzní služby: v TTO FN Brno a OHKT ÚVN Praha. Vyšetřování pomocí metod NAT (HIV 1, HIV 2, HBV a HCV) u dárců krve a jejích složek bylo v TTO FN Brno zavedeno v roce 2010 z důvodu zvýšení bezpečnosti hemoterapie, kdy hlavním podnětem byla varovná hemovigilanční data. V OHKT ÚVN Praha bylo zavedeno NAT testování dárců krve v roce 2013, kdy kromě shodného důvodu zvýšení bezpečnosti transfuzních přípravků hrála klíčovou roli harmonizace kvality transfuzních přípravků v rámci spojeneckých zemí NATO, a s tím související nově vydaný ČOS 65000314. Obě tato zařízení disponují dostatečnou kapacitou, aby v nich mohla být prováděna NAT vyšetření i pro ostatní zařízení transfuzní služby v ČR, a obě zařízení shodou okolností používají systém cobas s 201 od firmy Roche Diagnostics.
V ČR je ročně provedeno téměř 500 tisíc odběrů krve a jejích složek za účelem výroby transfuzních přípravků pro klinické použití. Kalkulované riziko přenosu infekce krevní transfuzí je v ČR u virových hepatitid 1:300 000, u HIV 1:2 000 000 podaných transfuzí. Přenos HIV krevní transfuzí v ČR dosud sice popsán nebyl, ale přenosy HBV nebo HCV zaznamenané jsou.
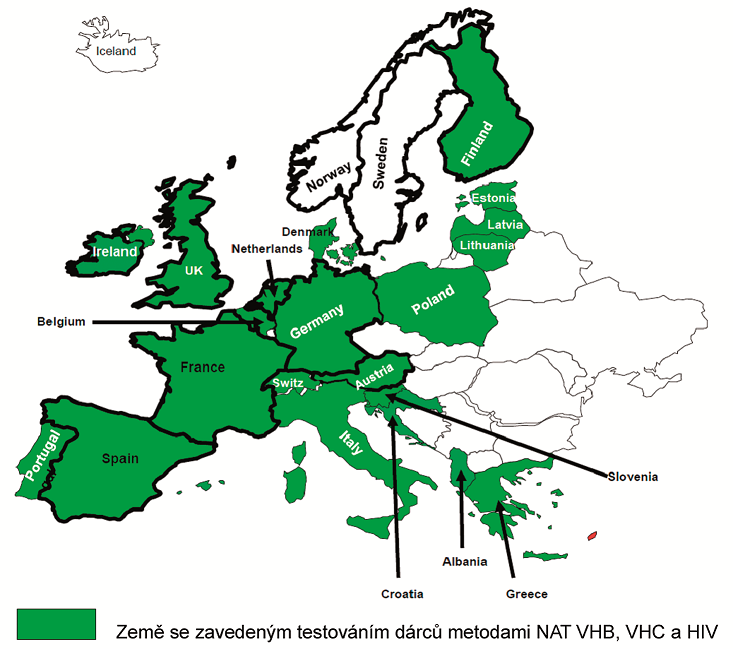
Zdroj: Roche, Grifols, autoři
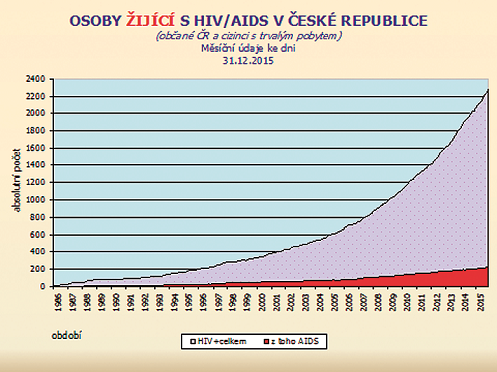
Zdroj: SZÚ, NRL pro HIV9
Zdroj: SZÚ, NRL pro VH 10
Nejohroženějšími skupinami pacientů jsou polytransfundovaní, zpravidla onkologičtí a hematoonkologičtí pacienti, kterým případný přenos závažné infekce dále významně komplikuje jejich již tak závažný zdravotní stav. K tragické události v tomto smyslu došlo v ČR na podzim roku 2015, kdy transfuzemi trombocytů byla přenesena infekce HCV na 3 dětské hematoonkologické pacienty a následně pak utrpěla profesionální nákazu zdravotní sestra. Jednalo se o krevní složky od pravidelného dárce trombocytů, vyrobené ze dvou aferetických odběrů v srpnu a září 2015. Rutinní sérologický screening na anti-HCV byl při obou odběrech negativní. Šetření formou loock-back nastalo poté, co byl dárce na podzim 2015 hospitalizován pro akutní virovou hepatitidu. Výsledky přešetření prostřednictvím Národní referenční laboratoře pro virové hepatitidy a též na OHKT ÚVN Praha prokázaly opakovanou negativitu protilátkovými sérologickými testy u obou odběrů trombocytů. Kombinovaný sérologický test anti-HCV + Ag HCV (Monolisa™ HCV Ag-Ab ULTRA, Bio-Rad) byl u prvního odběru negativní, u druhého reaktivní. Sérologický test pouze Ag HCV (ARCHITECT HCV Ag, Abbott) byl v obou případech reaktivní. V obou případech byly spolehlivě reaktivní NAT testy, včetně vyšetření provedených v poolu 24 i 96! na OHKT ÚVN (MPX v2.0, Roche).
Lze konstatovat, že úroveň bezpečnosti hemoterapie v ČR není v současné době vyhovující, rizika přenosu infekcí krví jsou vyšší než ve většině ostatních států Evropy a obecně akceptovaný standard testování krve dárců je opomíjen. Bezpečnost hemoterapie je možné výrazně zvýšit rozšířením vyšetřování dárců krve o povinnou detekci nukleových kyselin minimálně tří původců krví přenosných infekcí (HBV, HCV a HIV), aniž by to – při rozumném organizačním modelu – představovalo neúměrné zvýšení nákladů. Je potěšitelné, že k tomuto názoru se letos po letech diskuzí přiklonil i výbor Společnosti pro transfuzní lékařství ČLS JEP za podpory výboru České hematologické společnosti a výboru České hepatologické společnosti. Podnětem byla ovšem až série výše zmíněných přenosů HCV transfuzí. Zástupci odborné veřejnosti i SÚKL kladné stanovisko k zavedení metod NAT prezentovali na mimořádném jednání Národní transfuzní komise MZ ČR 26. ledna 2016.
V současné době je v kompetenci MZ ČR, zda a kdy bude legislativním opatřením rozšířen povinný screening vyšetřování dárců krve a jejích složek o metody NAT (minimálně RNA HIV, DNA HBV a RNA HCV). Takto bude zajištěna nejen vyšší úroveň bezpečnosti hemoterapie v ČR, ale bude dosaženo, byť se zpožděním, běžného standardu ostatních EU. Jedná se také o požadavek formulovaný hlavním hygienikem ČR, který v souvislosti s přenosy HCV v roce 2015 vyzval odbornou společnost k zavedení metod NAT u dárců krve dopisem ze dne 10. listopadu 2015.

Screening dárců krve na krví přenosné infekce na OHKT ÚVN Praha
Od září 2013 jsou dárci krve a jejích složek v ÚVN Praha sérologicky vyšetřováni elektrochemiluminiscenční metodou (ECLIA) na analyzátoru cobas® 8000 (Roche) – HBsAg, anti-HCV, anti-HIV + Agp 24 a syfilis – a souběžně NAT (HIV, HBV, HCV) metodou real-time PCR na analyzátoru cobas s 201 (Roche). V roce 2014 bylo dále zavedeno PCR testování HAV a parvoviru B19. Detekce nukleové kyseliny je prováděna v poolech plazmy dárců dvěma metodami: MPX v2.0 (HIV, HBV, HCV) v poolu 96 a metodou DPX (HAV, B19) v poolu 480 (pool = směsný vzorek z příslušného počtu primárních vzorků).
Kromě dárců krve ÚVN jsou v laboratoři dárců krve OHKT ÚVN smluvně testováni ještě dárci externích zařízení transfuzní služby, a to v současném celkovém objemu cca 350 000 dárců/rok sérologickými testy na screening protilátek i NAT testy na screening virové RNA/DNA. Pro tuto kapacitu je laboratoř aktuálně vybavena dvěma preanalytickými moduly cobas p 312, dvěma linkami cobas® 8000, kdy v každé z nich jsou zapojeny 3 analyzátory cobas e 602 se dvěma systémy cobas s 201, z nichž každý se skládá z pipetovacího poolovacího modulu MICROLAB STAR/STARlet IVD Hamilon, za kterým v off-line módu následuje vlastní PCR systém ve dvou on-line napojených modulech cobas® AmpliPrep + cobas® TaqMan® s vlastní řídicí jednotkou PDM. Součástí laboratoře je též automatický imunohematologický analyzátor Galileo, Immucor.
Do konce roku 2016 bylo v ÚVN otestováno pomocí NAT celkem 53 707 dárců krve a jejích složek. U dvou prvodárců byla zachycena infekce HCV společně s pozitivním testem anti-HCV a parvoviru B19. Od roku 2015 jsou v ÚVN Praha testováni i dárci z některých plazmaferetických center z ČR i ze zahraničí. Vyšetření probíhala zpočátku jen sérologicky, v průběhu 1. pololetí roku 2016 též pomocí metody NAT. Z 89 000 testovaných vzorků bylo do konce roku 2016 zachyceno 10 NAT reaktivních vzorků, z toho 7x HCV, 2x HBV, 1x HAV. Parvovirus B19, který je vyšetřován pouze PCR, byl zjištěn u 9 dárců.
Použité zkratky:
HIV – virus získaného selhání imunity
HBV – virus hepatitidy B
HCV – virus hepatitidy C
NAT – Nucleic Acid Test (test na zjišťo-vání přítomnosti kyseliny nukleové)
PCR – Polymerase Chain Reaction (polymerázová řetězová reakce)
RNA – ribonukleová kyselina
DNA – deoxyribonukleová kyselina
ČSL JEP – Česká lékařská společnost J. E. Purkyně
MZ ČR – Ministerstvo zdravotnictví ČR