Poruchy glukózové homeostázy podmiňující vzestup glykemie nad fyziologické rozmezí vedly od původního zjištění k potřebě hodnocení koncentrace glukózy v tělesných tekutinách. Zpočátku se jednalo o moč jako nejdostupnější zdroj informace. Přítomnost glukózy se prokazovala orientačně testovacími proužky a vedle toho kvantitativně polarimetricky. Z vyšetření moče se prováděl screening diabetu, který se však ukázal jako nepřesný, neboť renální práh pro glukózu byl velmi variabilní a řada pacientů s déle trvajícím diabetem nebyla včas odhalena. Vyšší hladiny glykemie totiž podmiňovaly narůstající nálož glukózy v primitivní moči, která aktivovala mechanismy zpětné resorpce zejména v proximálních tubulech ledvin prostřednictvím zvýšené exprese sodíko-glukózových transportérů SGLT2. Tímto mechanismem nebyla v moči ani při vyšších glykemiích, např. kolem 15 mmol/l, detekována glukóza. Moč se tudíž ukázala jako nevhodná, a to jak pro detekci diabetu, tak pro jeho další posuzování v rámci terapie.
Velmi brzy se proto testování zaměřilo na krev jako základní zdroj potřebné informace. Vedle enzymového stanovení glykemie využívajícího hexokinázovou nebo glukózooxidázovou reakci při fotometrickém stanovení v laboratoři se v sedmdesátých letech 20. století objevily první glukometry, které umožnily, aby si pacient mohl provádět přesnější vyšetření glykemie dokonce sám. Ještě před čtyřiceti lety nosil pacient na některých pracovištích do laboratoře eppendorfské zkumavky s pufrem, do nichž si sám doma nabíral kapilární krev do kapiláry. Brzy však zcela převládly glukometry, jejichž vývoj vedl postupně jednak k mnohem přesnějším výsledkům, jednak k jednodušší obsluze.
Výsledky velkých klinických studií u diabetu 1. typu (studie DCCT) i 2. typu (studie UKPDS), které se zaměřily na sledování diabetiků od stanovení diagnózy, ukázaly, že lepší kompenzace diabetu od počátku onemocnění vede k lepší prognóze onemocnění, tedy k nižšímu rozvoji cévních komplikací. Obě studie již využívaly u každého pacienta nejen monitoraci glykemie, ale i glykovaný hemoglobin.
Glykovaný hemoglobin jako ukazatel kompenzace diabetu
Objevení neenzymové glykace, tedy děje, při němž se váže glukóza na protein bez přítomnosti enzymu, vedl k širokému studiu proteinů a změn, které jsou touto reakcí podmíněny. Ukázalo se, že pozměněné molekuly proteinů vedou ke změně jejich vlastností, z nichž mnohé se podílejí na rozvoji komplikací diabetu. Celý proces je však daleko složitější, neboť právě vyšší koncentrace glukózy podmiňuje i další změny, jako např. oxidační stres aj. Jednou z molekul, která podléhá neenzymové glykaci, je i hemoglobin. A právě jeho jedna frakce, HbA1c, se stala zdrojem poznatků o dlouhodobém stavu diabetu. Výsledek glykace je totiž závislý jednak na koncentraci glukózy v daném prostředí a jednak na biologickém poločasu proteinu, který podléhá glykaci. Průměrná doba „života“ hemoglobinu je dána biologickým poločasem erytrocytů, jejichž průměrná životnost je 120 dnů. Glykovaný hemoglobin integruje koncentrace glukózy za poslední tři měsíce před měřením. Je však třeba uvést, že efekt procesu glykace se nepromítá do hodnoty HbA1c po celé tři měsíce stejně, ale že největší vliv má poslední měsíc před stanovením, který ovlivňuje hodnotu HbA1c až z padesáti procent. Naopak první ze tří měsíců se promítá nejméně, zhruba deseti procenty.
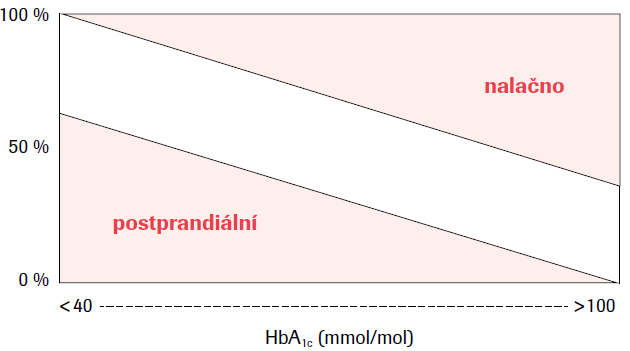
Během dne dochází k oscilacím glykemií a je třeba rozlišit glykemie nalačno a glykemie postprandiální. Zatímco u zdravého jedince je kolísání glykemií poměrně homogenní a v úzkém pásmu hodnot, zcela jiná je situace při diabetu. A právě velká variabilita glykemií může způsobovat u jednotlivých pacientů zcela odlišné hodnoty HbA1c. Je třeba uvést, že glykemie nalačno se promítají především do vyšších hodnot HbA1c, tedy u pacienta se zřetelnější dekompenzací podmiňující již vyšší „denní startovací“ glykemie. Naopak postprandiální glykemie ovlivňují nižší hodnoty HbA1c, jak popsal Monnier (viz obr. 1).1 Hodnoty HbA1c jsou tudíž výsledkem poměrně složité interakce, na níž se významně podílí i samotná míra variability glykemií. Prudké výkyvy glykemie s výraznými poklesy do hodnot pod 3,0 mmol/l a následnými vzestupy i přes 15 mmol/l mohou značně změnit výslednou hodnotu HbA1c v porovnání se stabilizovaným stavem. Podle toho, jak je pacient stabilizován a jak se mění jeho glykemie v dlouhodobém období, se mohou měnit i hodnoty glykovaného hemoglobinu. Proto vedle glykemií, z nichž můžeme usuzovat na krátkodobou variabilitu vyjadřovanou např. standardní odchylkou či variačním koeficientem, je možno hodnotit i HbA1c jako ukazatel dlouhodobé variability a v časové řadě, např. roku či několika let, posuzovat i variabilitu glykovaného hemoglobinu.
U diabetiků má variabilita glykemií i dlouhodobá variabilita glykovaného hemoglobinu vliv na rozvoj komplikací. Ukázalo se, že vedle výše glykemií a tím i výše HbA1c ovlivňuje právě jejich variabilita úroveň oxidačního stresu jako významného patogenetického mechanismu rozvoje komplikací.2 Tyto poznatky se promítají v současné době do moderní léčby diabetu. Průběh glykemií a jejich variabilita jsou významně ovlivněny právě volenou léčbou. Zatímco intenzivní léčba inzulinem může podmiňovat rychlé změny glykemií, a tedy vést ke značné oscilaci, léčba perorálními antidiabetiky vede vesměs k časově pomalejším oscilacím glykemie. Do toho se může navíc promítat i změněný charakter sekrece inzulinu u diabetu 2. typu s opožděnou a prodlouženou druhou fází sekrece. Do výsledné hodnoty HbA1c se jistě promítá životnost erytrocytů, a proto nepřekvapí, že u pacientů s hemoglobinopatiemi může být hodnocení tohoto parametru problematické a pak se může využít hodnocení fruktosaminu, tedy plazmatického ukazatele krátkodobější kompenzace, který odpovídá přibližně jen dvoutýdennímu průměru glykemií, neboť se jedná převážně o glykovaný albumin. Právě zkrácená životnost erytrocytů vede k myšlence, že výsledná koncentrace HbA1c není jen závislá na glykačním procesu, ale důležité je i odbourávání. A právě rychlost deglykace, jak prokázaly i studie s fruktosaminem, může ovlivnit výslednou hodnotu HbA1c.3 Tento děj ovlivněný aktivitou fruktosamin-3-kinázy je podmíněn její genetikou, která pak přispívá k výsledné úrovni deglykačního procesu.4 Kromě uvedených vlivů se dále mohou promítat u konkrétního pacienta i některé vlivy metabolické (hyperbilirubinemie, uremie, alkoholismus) nebo užívání léků (vitamin C a E), které též ovlivňují ať již oxidační stres či přímo proces glykace.
Je tedy zřejmé, že hodnota HbA1c může být značně individuální, i když základní proces tvorby biochemickým dějem je jednoznačný. Z tohoto hlediska se klinické využití HbA1c při posuzování dlouhodobé kompenzace diabetu promítá více do hodnocení škály, a tedy vývoje v určitém časovém období, než v absolutizaci jednoho vyšetření. Na druhé straně je nezpochybnitelné, že HbA1c poskytuje základní informaci o stavu diabetu a jeho hodnoty jsou podkladem při rozhodování o volbě léčby.
Nové parametry hodnocení kompenzace diabetu
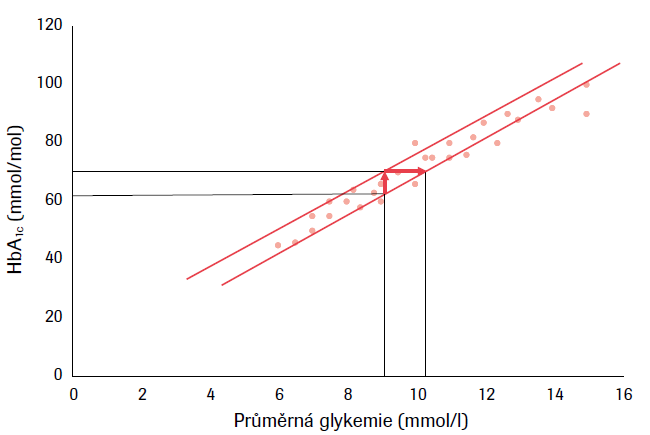
Individuální situace, v níž se nachází diabetik se zřetelem k aktuální hodnotě HbA1c, není proto jednoduchá z hlediska své interpretace. Z tohoto pohledu nepřekvapí, že aktuální hodnota HbA1c neodpovídá u konkrétního pacienta stejné průměrné hodnotě glykemie jako u jiného pacienta, byť počítané za poslední tři měsíce glukózovým senzorem. Znamená to, že při zpracování velké skupiny diabetiků se získá grafická závislost obou proměnných, která se promítá do pásu a nikoli do přímky (viz obr. 2). Určité hodnotě HbA1c pak přísluší interval průměrných glykemií, a naopak jedné průměrné glykemii odpovídá interval hodnot HbA1c. Studium nesrovnalostí výsledků HbA1c s hodnotami fruktosaminu a průměrnými glykemiemi vedlo k průkazu tzv. glykačního gapu (GGap), který vyjadřuje rozdíl mezi naměřenou glykací vyjádřenou hodnotou fruktosaminu a HbA1c na základě regrese obou parametrů.3 Vedle toho byl navržen ještě tzv. index glykace hemoglobinu (hemoglobin glycation index, HGI), který je rozdílem stanoveným na podkladě regrese mezi průměrnou glykemií a HbA1c.
Využití glukózového senzoru pro kontinuální monitoraci glykemie CGM u diabetiků vedlo k diskusi o stanovení odhadovaného HbA1c (estimated HbA1c, eHbA1c nebo též eA1c). Průměrná glykemie z CGM poskytuje přesnou informaci u daného pacienta, na jejímž základě komise expertů navrhla nový pojem místo eHbA1c označený jako „glucose management indicator“ (GMI).5 Tento parametr byl analyzován ve studiích využívajících senzory CGM a na základě získaných výsledků byl odvozen jeho výpočet s hodnotami odpovídajícími HbA1c podle IFCC: GMI v mmol/mol = 12,71 + 4,70587 x průměrná glykemie [v mmol/l] Hodnoty GMI jsou zpřesněním vyjádřené kompenzace diabetu u daného pacienta a jsou určeny k vedení léčby. To vysvětluje i název tohoto parametru. Analýzy ukázaly, že jeho hodnota je buď vyšší, nebo nižší než naměřená hodnota HbA1c, nicméně rozdíl mezi laboratorně změřeným HbA1c a GMI u daného pacienta zůstává poměrně stabilní.5 GMI umožňuje více individualizovat cíle léčby. Pokud je GMI nižší než změřený HbA1c, může indikovat více riziko hypoglykemie a tím i vést k úpravě (snížení) dávek inzulinu. Naopak GMI vyšší než HbA1c je signálem, že jsou vyšší glykemie, a v tom případě může vést k navýšení dávek inzulinu. Je jasné, že toto nové vyjadřování kompenzace platí hlavně pro diabetiky 1. typu, případně 2. typu léčené inzulinem. Pro diabetes 2. typu léčený antidiabetiky kromě inzulinu nejsou data ve vztahu k těmto parametrům k dispozici.
Vedle uvedených parametrů se v monitorovacím systému CGM včetně FGM (flash glucose monitoring, okamžité monitorování glykemie) používaném u diabetiků využívá hodnocení setrvání v požadovaném rozpětí glykemií 3,9–10,0 mmol/l, označené jako TIR (time in range). Vyjadřuje se procentem času ze 24 hodin. Současně se hodnotí doba strávená v hypoglykemii a dále v hyperglykemii, obojí též v procentech z denní doby. Cílem je, aby TIR bylo co nejvyšší, aspoň 70 %, kdežto doba s hodnotami
pod 3,9 mmol/l by měla být menší než 5 %. Kontinuální senzory tak posouvají možnosti kompenzace i její úpravy dále. Mezi TIR a HbA1c byl doložen inverzní vztah u diabetiků 1. i 2. typu.6
HbA1c jako ukazatel rizika komplikací
Obě velké studie (DCCT a UKPDS) ukázaly, že stav kompenzace diabetu stanovený glykovaným hemoglobinem ovlivňuje riziko rozvoje cévních komplikací. Glykovaný hemoglobin se tak stal prognostickým markerem těchto změn. Studie DCCT prokázala exponenciální nárůst mikrovaskulárních komplikací u diabetu 1. typu při zvyšující se hodnotě HbA1c nad 7 %. Podobnou závislost uvedla studie UKPDS u diabetu 2. typu, kdežto makrovaskulární komplikace vykazovaly u těchto pacientů méně výrazný vzestup s narůstající hodnotou HbA1c. Vedle absolutní hodnoty měla výrazný efekt i dlouhodobá variabilita glykemií promítající se do hodnot HbA1c, takže jeho vyšší variabilita podmínila větší rozvoj komplikací.2 Proto byl v dalších studiích u diabetu 2. typu kladen důraz na co nejlepší kompenzaci v intervenované skupině s cílem přiblížit HbA1c normálním hodnotám. V těchto studiích (např. ACCORD) došlo v důsledku intenzivní léčby k častějšímu výskytu hypoglykemií s možnými kardiovaskulárními důsledky. Při hlubší subanalýze se ukázalo, že právě u osob s vyšším glykačním indexem hemoglobinu (HGI) byla vyšší mortalita, kdežto hodnocení HbA1c nemuselo poskytnout vysvětlení.7 Jednalo se tudíž o podskupinu diabetiků, u nichž se uplatnil rozdíl v glykaci mezi laboratorně nadhodnoceným HbA1c a skutečnou průměrnou glykemií.
HbA1c a diagnostika diabetu
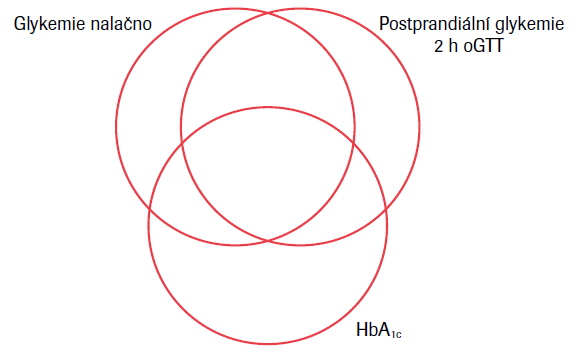
Porucha glukózové homeostázy podmiňující zvýšené glykemie vede k riziku cévních změn. HbA1c jako indikátor těchto změn byl proto navržen jako diagnostický ukazatel rizika. Z tohoto hlediska může být jeho zvýšená hodnota považována za parametr určující diagnózu diabetu. Na základě provedených analýz ve studiích byl HbA1c navržen jako kritérium pro diagnózu diabetu vedle glykemie nalačno a glykemie během orálního glukózového tolerančního testu (oGTT).8 V USA se stal od r. 2012 glykovaný hemoglobin HbA1c (nebo též A1c) součástí kritérií určujících diagnózu diabetu vedle glykemie nalačno a glykemie za 2 hodiny po požití glukózy při oGTT, přičemž hodnota ≥6,5 % (48 mmol/mol) se stala hranicí pro diagnózu diabetu. Bylo to po mnohaleté standardizaci metod pro glykovaný hemoglobin probíhající v USA. Srovnání tří parametrů v diagnostice diabetu, tj. glykemie nalačno, glykemie za 2 hodiny při oGTT a HbA1c, však ukázalo tři jen zčásti se překrývající množiny pacientů s diabetem.9 Jenom 26 % osob diagnostikovaných jako diabetici pomocí glykemie nalačno nebo glykemie po 2 hodinách oGTT mělo současně zvýšenou hodnotu HbA1c (≥6,5 %), zatímco 55 % diabetiků diagnostikovaných podle HbA1c ≥6,5 % splňovalo kritéria diabetu podle glykemií. Tyto rozdíly konkretizují naše představy o překrývání pozitivních diagnostických nálezů a naopak ukazují, jak se liší diagnostika diabetu provedená podle glykemických kritérií nebo podle HbA1c. Populace diabetiků tudíž není v obou případech identická. Schematicky je možno tuto situaci znázornit částečně se překrývajícími kružnicemi vyjadřujícími množinu pacientů s diabetem stanoveným podle glykemie nalačno, glykemie po 2 hodinách při oGTT nebo pomocí HbA1c (viz obr. 3).
V České republice na rozdíl od USA nepoužíváme HbA1c jako diagnostické kritérium diabetu, neboť neproběhla poměrně náročná standardizace stanovení HbA1c v rámci laboratoří. HbA1c byl navržen pouze jako možný screeningový ukazatel u prediabetu (viz doporučený postup ČDS pro prediabetes, www.diab.cz),10 kdežto potvrzení diagnózy diabetu je založeno na glykemických kritériích. Je třeba mít na paměti, že aktuální situace charakterizovaná ať již glykemií nalačno, do níž se promítá zejména noční regulace glukózové homeostázy (včetně např. jaterní glukoneogeneze), nebo postprandiální glykemií, která je výsledkem jak sekrece inzulinu, tak jeho účinku v cílových tkáních, se zcela liší od glykovaného hemoglobinu, jehož hodnota je závislá na procesu glykace, ale i deglykace v průběhu řady týdnů. Tyto rozdíly je třeba mít na paměti při posuzování těchto laboratorních ukazatelů, které se však mohou dobře doplňovat při hodnocení dlouhodobé situace u diabetiků.
Závěr
HbA1c poskytuje i v současné době základní informaci o stavu kompenzace diabetu, i když se ukázalo, že ke správnému posouzení jsou potřebné některé korekce (GGap, HGI, GMI). Zároveň může být využit jako prognostický ukazatel pro rozvoj pozdních (cévních) komplikací. Přestože byl zaveden i do diagnostiky diabetu, jeho posuzování v rámci potvrzení diagnózy diabetu může přinášet obtížnou interpretaci, neboť se v rámci diagnostiky neuvažují zmíněné korekce podmíněné rozdíly mezi glykací a primárními glykemiemi. Dosud však HbA1c zůstává důležitým biomarkerem v diabetologii.