Na úvod si můžeme položit dvě otázky: Proč je nabízeno laboratořím stanovení celkového vitaminu B12 i tzv. aktivní formy? Co je tak zajímavého na vitaminu B12, že se dostaly na trh relativně krátce po sobě komerční soupravy stanovující obě formy analytu na automatických analyzátorech?
Na tyto otázky víceméně odpovídá P. H. Golding1 , kterého ale spíše zaujal tzv. Herbertův model2 . Tento model popisuje biochemický a hematologický sled událostí, jejichž následkem je negativní bilance vitaminu B12. Nevědomky tím položil i základ pro komercionalizaci holotranskobalaminu (aktivní B12).
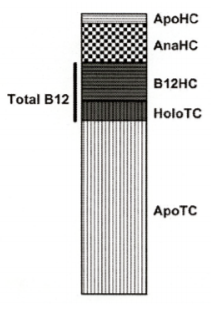
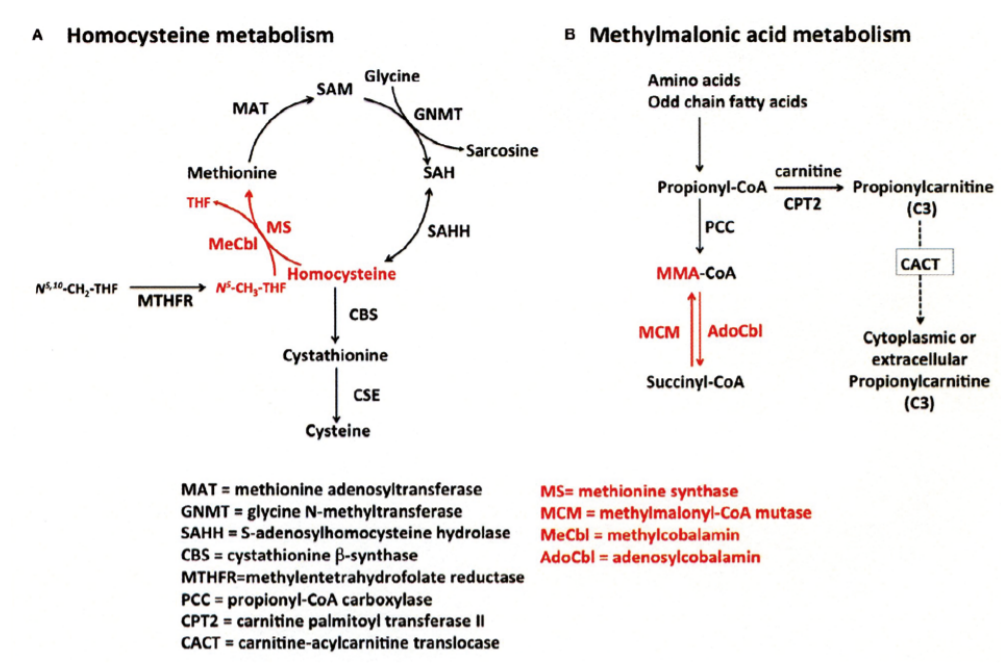
Pokusme se s pomocí literárních zdrojů představit analyt, o kterém mluvíme. U zdravého člověka žaludeční kyseliny oddělují B12 od bílkovin, haptokorin (HC) ze slin pak uvolněný B12 váže za vzniku holohaptokorinu (holoHC). Zvýšené pH ve dvanáctníku znovu uvolní B12 z vazby na haptokorin a umožní jeho navázání k vnitřnímu faktoru (IF), produkovanému parietálními buňkami žaludku, za vzniku komplexu IF-B12 ve dvanáctníku. Přesedání během putování je nezbytností. V jednu chvíli je chráněn před hydrolýzou v kyselém prostředí a o kousek dále je jeho nosič haptokorin degradován enzymy vylučovanými pankreatem, aby přestoupil na vnitřní faktor, který je vůči proteolytickým enzymům odolný.20
V terminálním ileu cesta končí, IF je absorbován endocytózou. Zprostředkována je komplexem cubam. Komplex se skládá ze dvou spolupracujících molekul: cubilinu, vážícího vnitřní faktor, a molekuly označované jako amnionless (AMN), která obstarává ukotvení v membráně a zajišťuje endocytické schopnosti. Uvnitř enterocytu je vnitřní faktor degradován proteázami lyzozomu. Uvolněný B12 uniká pravděpodobně s pomocí proteinu LMBD1 membránou lyzozomu do cytoplazmy. Na opačném konci enterocytu, pravděpodobně s pomocí transportérového proteinu MRP1, proniká volný B12 do portální žíly, kde se následně váže na haptokorin (holoHC) a transkobalamin (holoTC).20 Odkud se berou nosiče B12, není příliš jasné. HoloHC putuje do jater, kde je vitamin oddělen a uskladněn. HoloTC přechází do oběhu a je distribuován k buňkám, které jej potřebují. Nyní je nutné ještě přidat regulační principy. Při vzniku potřeby B12 pravděpodobně synergicky působí dva „dveřníci“ pro vitamin B12. Jednak se zvyšuje produkce IF a současně se zvyšuje uvolňování holoHC do žluči z jater, takže se dostává do dvanáctníku a podstupuje znovu proces vstřebávání.3,4,5,6
Nutno ještě podotknout, že holoTC představuje menšinu cirkulujícího B12, a TC je saturován asi jen z 10 %. Haptokorin je nosičem i neaktivních forem vitaminu B12. Hladiny transportních proteinů nemají diurnální výkyvy a nekolísají ani při stravě bohaté na B12. Nejsou výraznější rozdíly mezi pohlavími. V těhotenství je popisován pokles hladiny B12 v posledním trimestru, ale nikoliv k hranici deficitu.
Hladina nosiče transkobalaminu se nemění ani při deficitu vitaminu. Naopak k poklesu může dojít při zvýšeném příjmu B12. Vyplývá to pravděpodobně z faktu, že buněčný receptor, pomocí kterého vstupuje do cílové buňky, má vyšší afinitu k holoTC a s jeho zvýšeným vstupem do buněk dojde k přechodnému snížení v krvi, než se ustanoví nová rovnováha mezi apoTC a holoTC.
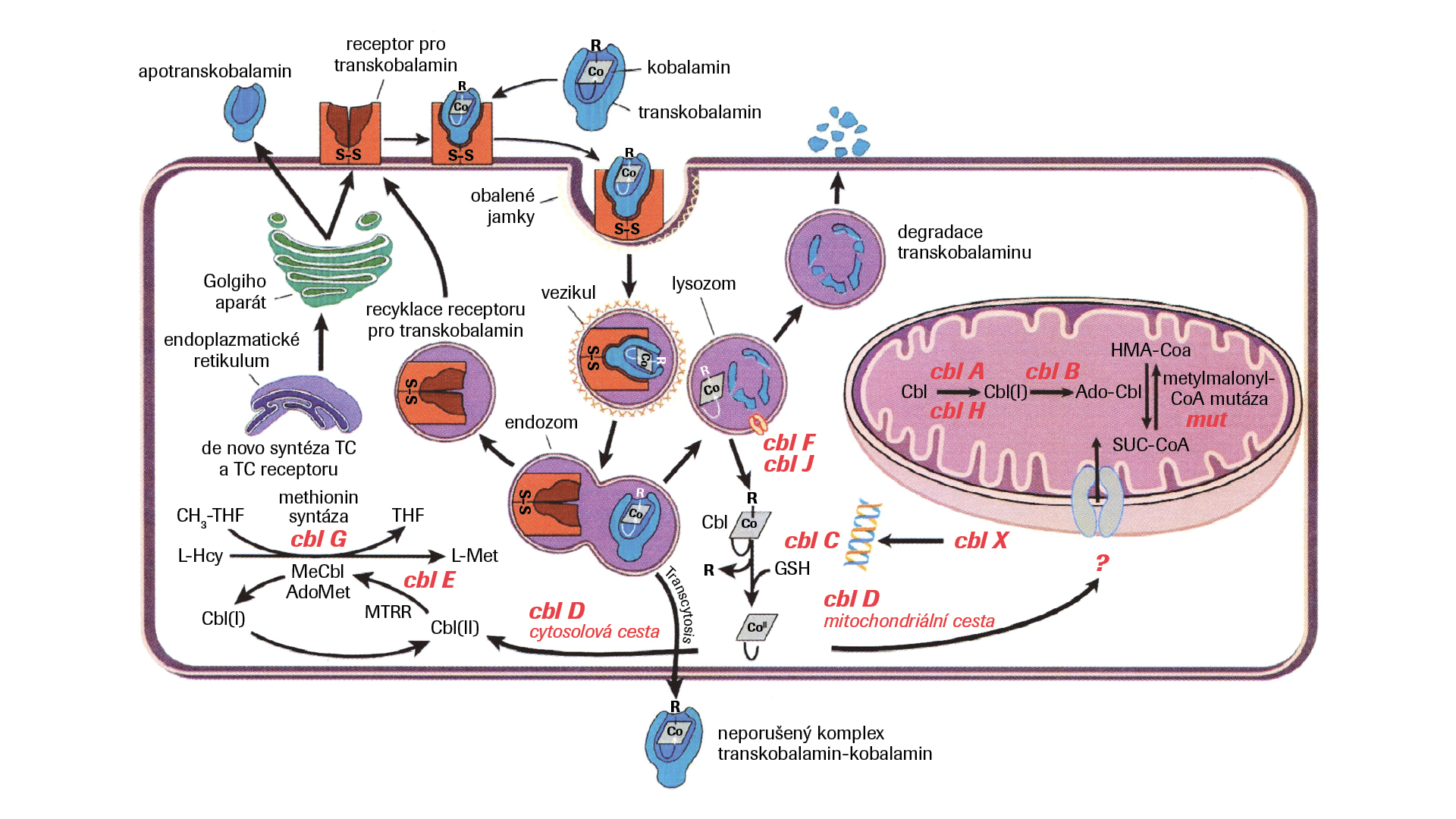
Když víte kudy a kam, je vhodná chvíle říci i proč. Vitamin B12, respektive dvě jeho formy, a to metylkobalamin a adenosylkobalamin, se jako kofaktor zásadním způsobem podílí na dvou metabolických procesech:
1. Metabolismus homocysteinu, metylkobalamin. Homocystein může být metabolizován transsulfurační cestou na cystein (enzymem cystationová β-syntáza – CBS), tato reakce je závislá na vitaminu B6. Druhou cestou je přenos metylové skupiny z homocysteinu (Hcy) na methionin za působení enzymu methioninsyntázy (MS). Kofaktorem methioninsyntázy je právě metylkobalamin. Pro úspěšný průběh této reakce jsou rovněž důležité esenciální foláty a enzym MTHFR. Z výše zmíněného vyplývá, že kromě nutričního nedostatku vitaminu B12 hladinu Hcy v plazmě významně ovlivňuje snížená funkce CBS a MTHFR, ale hlavně i nedostatečný přísun folátu. Je nutno doplnit, že další enzymy metabolických drah, které mají vliv na hladinu Hcy (cystathioninová β-syntáza a S-adenosylhomocysteinhydroláza – SAHH), jsou nezávislé na hladinách vitaminu B12.
2. Metabolismus metylmalonové kyseliny (MMA), adenosylkobalamin. MMA je produkován během katabolismu mastných kyselin a aminokyselin s lichým počtem uhlíků v mitochondriích. Propionyl-CoA je prekurzor MMA v reakci katalyzované propionyl-CoA karboxylázou (PCC). Vrozené vady enzymu PCC vedou k propionikacidemii. Podobně mutace metylmalonyl-CoA mutázy (MCM) závislé na AdoCbl vedou k hromadění MMA-CoA a inhibici PCC, která se projevuje jak zvýšením propionyl-CoA, tak i kyseliny propionové v cirkulaci. Výživový či funkční deficit vitaminu B12 má za následek inaktivaci MCM a zvýšení substrátu MM-CoA, který vstupuje do oběhu jako MMA.7
Nyní, když jsme si snad dostatečně vysvětlili, jakých metabolických reakcí se vitamin B12 účastní, je nám jasný i význam a důvody jeho stanovení:
• neurologické poruchy (tvorba myelinu);
• hromadění Hcy a MMA;
• megaloblastická anémie (syntéza DNA), hypersegmentace lymfocytů;
• hladina B12 ovlivněná léky obsahujícími inhibitory protonové pumpy, metformin;
• součást diagnostiky poruch vstřebávání;
• prevence Alzheimera.
Při bližším průzkumu vyšetření nabízených v laboratořích napříč republikou zjistíme, že většina nabízí stanovení jak celkového B12, tak jeho aktivní formy s dovětkem, že aktivní forma je preferovaná jakožto specifičtější a rychlejší ukazatel deficitu vitaminu B12. Najdou se i „progresivní“ laboratoře, které již stanovení celkového B12 nahradily výhradně stanovením holoTC. Avšak ani holoTC není tak dokonalým testem, jak by se mohlo na první pohled zdát. Pojďme si shrnout problematické aspekty stanovení aktivního vitaminu B12:
1) Poločas trvání
Různé zdroje uvádějí, že holoTC má poločas: 2 dny15, 18 hodin16, <2 hodiny17, 60–90 minut18, 6 minut19. Takže tu máme první problém, který vlastně sledujeme, když budeme měřit aktivní formu. Není to jen kratičký výřez v časové ose, kdy se hladina rychle mění podle potřeby v cílových tkáních? Nebo jde o dlouhodobě stabilní hladinu s rychlou obrátkou?
2) Citlivost k absorpci
S prvním bodem je úzce spjata také často diskutovaná citlivost holoTC k absorpci vitaminu B12. Názory autorů na tento problém se různí, jak výstižně shrnul ve své práci Golding1. A opět zde vyvstává otázka, jestliže se hladina holoTC po podání vitaminu B12 zvedne, ukazuje nám jeho koncentrace opravdu dlouhodobý status, anebo jen hladinu po nedávné absorpci? Jak může být holotranskobalamin považován současně za marker časné deficience vitaminu B12 a zároveň za marker jeho absorpce?
3) Homeostáza holoTC
Většina publikací i výrobců se při propagaci holoTC opírá o výsledky dr. Herberta, který pokládá holoTC za první metabolit reagující na deficienci, nebo chceme-li sníženou absorpci, vitaminu B12.8 Tato hypotéza však má opět několik úskalí. U zdravého jedince, který nemá porušenu absorpci vitaminu B12, ale pouze jeho deficit v potravě, trvá několik desítek let, než se vyvine deficit z důvodu existence enterohepatálního oběhu. Každý jedinec má ve svém těle zásobu přibližně 2–3 mg vitaminu B12, přičemž většina je lokalizována v játrech. Odtud je každý den přibližně 1,4 μg secernováno žlučí zpět do střeva, kde je opět B12 zpracován stejným způsobem jako vitamin z potravy. Reabsorpce tohoto „zásobního“ B12 je přibližně 50%.9,10 Tento fakt ve své publikaci připouští i Herbert. Je ovšem jasné, že v tomto případě k poklesu holotranskobalaminu nedojde, i když fakticky již nastal jeho deficit. Herbertova hypotéza holoTC jakožto prvního markeru deficitu B12 je tak platná pouze v případě, že dojde k náhlé změně vstřebávání vitaminu B12. To může být způsobeno např. přerušením tvorby IF, žluči či při odnětí části duodena či ilea, kdy recyklovaný B12 nedokáže být zpracován stejně jako ten z potravy. Nicméně při výše zmíněných stavech (např. při resekci žaludku) si jsou lékaři vědomi nebezpečí nedostatku B12 a pacienta suplementují lékovou formou vitaminu B12. Tyto syntetické formy vitaminu B12 nejsou vázány na bílkoviny, jako je tomu v potravě, a nepotřebují tudíž ke svému úspěšnému vstřebání IF ani ostatní faktory. Navíc velké množství podávaného B12 nepotřebuje ke svému průchodu přes střevní sliznici receptory, ale prochází volně pasivní difuzí.9 Takže i v těchto případech, pokud je pacient správně suplementován, nedochází k deficitu vitaminu B12 ani jeho aktivní formy.
4) Nejednotný cut-off
Stanovení holotranskobalaminu je často doporučováno především v tzv. šedé zóně celkového vitaminu B12, která je udávána v rozsahu 150–300 pmol/l, a kdy se předpokládá, že stanovení holoTC je přesnější a diagnosticky cennější.11 Avšak i u stanovení aktivního B12 je nejednotnost v referenčních mezích a především pak ve spodní hranici, odkdy jsou výsledky stanovení holoTC považovány za patologické. Tato cut-off hodnota se v českých laboratořích pohybuje od 19 do 38 pmol/l, v zahraničních publikacích se často uvádí jako mezní hodnota až 50 pmol/l.1 Tyto rozdílné meze jsou částečně dány tím, že hodnoty holoTC se liší, stejně jako jiné imunochemické metody, v závislosti na použitém testovacím systému. Avšak jak ukázal Devalia, interpretace získaných výsledků se liší nejen mezi výrobci, ale i v rámci jedné skupiny, kdy je dosaženo stejné hodnoty.12 Takže se zdá, že i holoTC má stejnou šedou zónu jako celkový vitamin B12, kdy je interpretace získaných výsledků velmi nejednotná. V zahraniční literatuře se v případě výsledků v rozmezí 25–50 pmol/l doporučuje stanovení některého z dalších markerů, jako je celkový B12, homocystein či metylmalonát.13 Nevytrácí se však tímto výhody stanovení holoTC?
5) Problematika principu stanovení
Soupravy používají ke stanovení B12 značený vnitřní faktor. Přirozené protilátky proti vnitřnímu faktoru, vyskytující se při perniciózní anémii, mohou způsobit falešně zvýšené hodnoty B12. Je nanejvýš vhodné si ověřit, zda použitá souprava je vůči tomuto efektu odolná.
Výsledky pozorování:
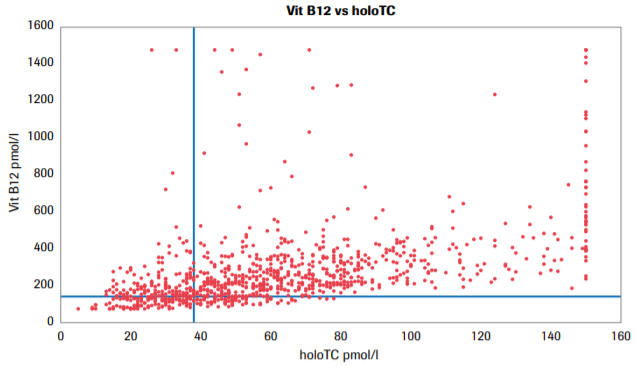
1. Vyhodnotili jsme soubor 651 pacientů hematologické poradny s mediánem věku 68 let (14–98) indikovaných ke stanovení vitaminu B12 na základě klinického vyšetření. Na základě regrese a grafického znázornění vztahu mezi B12 a holoTC nelze jednoznačně říci, že by stanovení aktivní formy, či spíše biologicky dostupné formy vitaminu B12 přinášelo výrazný profit oproti stanovení celkového B12 (graf č. 1). Jedná se spíše o psychické uspokojení, že stanovuji akční metabolit místo analytu, který vypovídá spíše o celkových zásobách vitaminu. Když se to budeme snažit vyjádřit přesněji, musíme konstatovat, že 40 % vzorků mělo holoTC nad kritickou hladinou, kdy by podle VB12 (zásoba) poukazovala na deficit. Při pohledu na druhou stranu grafu najdeme 18 % vzorků, kdy holoTC signalizuje depleci, i když je celkový VB12 v normě. Naprostým extrémem je poměr 26, resp. 33 mg/l holoTC vůči hodnotě VB12 vyšší, než je horní hranice rozsahu měření.
2. Literatura uvádí, že nedostatek vitaminu je provázen klinickými příznaky. Mezi ně patří i střední objem erytrocytů. Porovnáním obou skupin vzorků rozdělených podle hladiny VB12 zjistíme, že nedostatkem trpící skupina má medián 93,3 (62,7–122) a zásob si užívající skupina má medián 92 (58,4–141) fl. Stejný obraz poskytuje i varianta s holoTC, kdy pacienti s deficitem měli medián MCV 92,5 a bez deficitu 92,1 fl. V obou případech statisticky nevýznamný rozdíl.
3. Porovnání s hodnotami Hcy nebylo provedeno kvůli nízkému počtu výsledků v rámci vybraného souboru. Stranou také zůstaly hodnoty ferritinu, receptoru, protože víceprvková analýza zohledňující nedostatek železa a MCV by asi nic nepřinesla.
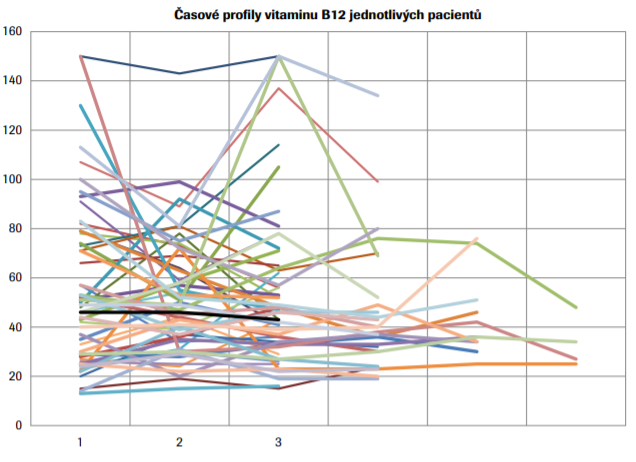
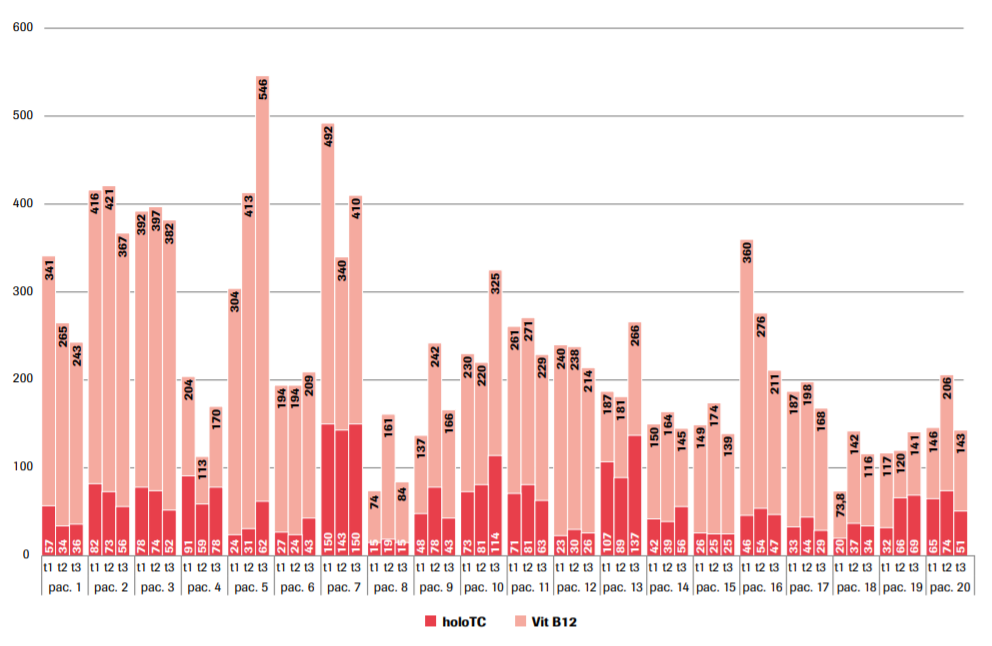
4. Dále lze porovnat individuálnost hodnot v tom smyslu, že ve skupině jsou pacienti, u nichž lze sledovat vývoj v čase, a zde by bylo možno najít nějaké odpovědi (graf č. 2 a 3). Bohužel intervaly mezi jednotlivými odběry nejsou jednotné, ale liší se pacient od pacienta. Dle lékařů hematologické poradny dostávají pacienti indikovaní k odběru pro stanovení B12 intramuskulárně dávku 1 000 mg B12, která je opakována s každou návštěvou ordinace. Lze pozorovat, že pacienti si vytvoří jakousi individuální hladinu vitaminu, která se u většiny z nich časem příliš nemění. Rovněž lze pozorovat jistou korelaci mezi celkovou hodnotou B12 a holoTC. Konkrétně Spearmanův korelační koeficient mezi vitaminem B12 a holoTC dosahuje hodnoty 0,6234 na hladině významnosti P <0,0001.
Jedna zásadní odpověď je však jasná. Herbertův model, či spíše přístup k problematice, je z praktického hlediska poněkud nelogický.
Běžně se nehledá deficit vitaminu B12 a s ním spojená anémie, pro kterou jsme ani nezjistili její procentuální zastoupení v celkovém počtu anémií. Hledají se především pomocí logického pavouka důvody anémie. V něm je anémie z nedostatku vitaminu B12 jednou z mnoha příčin. Budeme-li se držet tohoto přístupu, pak stanovení obou variant B12 se stane přínosným.
Ne vždy je nedostatek B12 primární příčinou, nýbrž jen průvodním projevem, a společně s údaji z osobní anamnézy mohou současně stanovené hodnoty celkového a aktivního B12 výrazně přispět k odhalení příčin anémie.
Nicméně jsou tu i jiná zajímavá místa, na která by se nemělo zapomínat, mezi ně patří stanovení VB12 u pacientů požívajících metformin či inhibitory protonové pumpy a celá oblast neurologie. Naléhavost stanovení pak roste s přibývajícím věkem pacientů.
Rádi bychom poděkovali MUDr. Adrianě Heindorfer a MUDr. Lence Walterové z oddělení klinické hematologie za podporu a pomoc s výběrem pacientů a odborné konzultace. Paní Ing. Heleně Švébišové za možnost použití přesně a správně pracujícího analyzátoru COBAS INTEGRA® 800.